
2019年FDA批准48款新药、高调结束了21世纪第二个10年。这10年是制药工业复苏的10年,不仅新药产出数量远超第一个10年、而且很多新技术进入成熟期。基因疗法、细胞疗法、RNAi、ASO、双特异抗体、ADC这些2009年时还是科幻或非主流的技术现在已经都有不止一个药物上市,基因编辑、蛋白降解等当时做梦也想不到的技术也已经开始了人体临床试验。
Continue reading …
今天Spectrum Pharmaceuticals (SPPI)公布了其外显子20插入变异EGFR抑制剂poziotinib在一个叫做ZENITH20的二期临床部分结果。
Continue reading …
今天FDA批准了第一三共和阿斯列康的HER2 ADC药物Enhertu (通用名fam-trastuzumab deruxtecan-nxki,中文暂时译为嗯HER2)用于HER2阳性、至少接受两种HER2疗法的晚期乳腺癌患者。
Continue reading …
今天诺华宣布将终止从Aduro收购STING激动剂ADU-S100的开发,主要是与诺华自己的PD-1抗体spartalizumab、与施贵宝Yervoy的组合疗法开发,
Continue reading …
今天AZN和三共在SABCS年会上公布了其HER2 ADC药物trastuzumab deruxtecan (DS-8201)的一个叫做Destiny-Breast01的二期临床结果。这个单臂试验招募184位对已有HER药物、包括罗氏ADC药物Kadcyla耐药的HER2阳性乳腺癌患者
Continue reading …
今天Incyte宣布FDA接受了其FGFR抑制剂pemigatinib在FGFR2融合或易位晚期胆管癌二线以后治疗的上市申请。在一个叫做FIGHT-202的二期临床试验中pemigatinib在这个人群产生36%应答率、中位应答时间为7.5个月。
Continue reading …
今天在亚洲ESMO年会上加拿大生物技术公司Zymeworks与合作伙伴百济神州公布了其HER2双特异抗体ZW25的一个晚期实体瘤一期临床结果。这个试验招募69位晚期HER2表达非乳腺癌实体瘤患者
Continue reading …
今天FDA通过加速审批通道批准了百济神州的BTK抑制剂Brukinsa (通用名zanubrutinib)用于治疗至少失败一种疗法的套细胞淋巴瘤。这个审批是根据一个86人参与的单臂临床试验结果,Brukinsa在这个人群的应答率为84%、中值应答时间为19.5个月。
Continue reading …
今天在SITC年会上匹斯堡大学的Kirkwood教授汇报了Checkmate Pharmaceutical的TLR9激动剂CMP-001单方或与K药组合在K药耐药恶黑患者的一个二期临床结果。
Continue reading …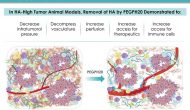
今天美国生物技术公司Halozyme宣布其透明质酸酶制剂PEGPH20在一个叫做HALO-301的胰腺癌三期临床失败。这个试验在吉西他滨和ABRAXANE®背景上比较PEGPH20与安慰剂作为晚期胰腺癌一线药物对OS的影响,
Continue reading …
今天美国生物技术公司Mirati在 EORTC-NCI-AACR年会上公布了其G12C变异Kras药物MRTX849的首批临床数据。在6位使用最高剂量MRTX849(600毫克一日两次)的NSCLC患者中有3位达到部分应答、但有2例尚未经中心机构确认。四位高剂量CRC患者有一例应答、并已经确认。首次消息影响MRTX股票上扬22%。
Continue reading …
























 微信号:美中药源
微信号:美中药源