ADC到底是什么(二十六)肿瘤空间特异性与异质性

肿瘤组织因为变异细胞获得指挥权因此与正常组织有较大不同,有一定特异性。比如增长过快可导致毛细血管残缺,令药物分子从血液循环进入肿瘤组织比进入正常组织更容易。这对生物大分子尤其明显,产生了所谓EPR效应、但最近也有研究显示即使对于纳米制剂EPR效应主要来自主动运输而不是血管泄露[1]。
达到肿瘤组织的药物不一定能到达每个肿瘤细胞,因为肿瘤组织细胞间质压力高于正常组织、有的可以接近血压。另外肿瘤组织细胞外间质(ECM)更密集、表达很多外排泵、血管分布异常、淋巴系统排泄不畅等因素也导致药物很难到达某些区域[2]。肿瘤异质性是肿瘤药物开发的一个核心障碍,基因异质性很容易理解、不同肿瘤细胞内部结构不同导致对药物敏感度不同。但肿瘤空间异质性也是一个障碍,即使一模一样的两个肿瘤细胞因为空间位置的不同也可能对同一药物敏感度不同。
肿瘤组织与正常组织的区别好比落败村庄与现代城市之区别。规划良好的城市通向每个住户都有畅通的路径,快递小哥可以轻易到达任何一个地址。但货物从外地通过大货车运入城市比较困难,因为交通规则复杂、各种限号限行。这与偏远村庄形成鲜明对比,道路没有限制、没有红绿灯交通警,大货车很容易进入。但田间地头可能长满灌木杂草,很多角落快递小哥很难到达。
因为肿瘤组织血管结构漏洞较多,所以无论小分子化疗药物还是ADC到达肿瘤都不比到达正常组织困难,但肿瘤与正常组织比最后一公里是更大难题。肿瘤内部街道通行困难,但如果你有一些临街房子的钥匙,能从前门进去后门出去、覆盖面积可以显著提升。所以旁观者杀伤不仅可以杀伤抗原阴性肿瘤细胞,也可以更有效杀伤ADC药物及其毒素自己空间上不可触及的肿瘤细胞(包括抗原阳性)。
理论上如果一个小分子化疗药物可以自由进出肿瘤细胞(如有旁观者杀伤的ADC毒素),那么没有ADC的运载也可以通过穿过处于肿瘤组织外层的肿瘤细胞而进入肿瘤深处,但胞吞转运 (transcytosis)通常不是小分子药物穿透组织的主要机制、与ADC旁观者杀伤比较有几个关键劣势。一是化疗药物从血液进入肿瘤,因为毒性很大所以药物浓度受到MTD限制,这导致进入肿瘤组织的药物也受限制。而ADC药物在毒素卸载之前本身无活性,所以在血液中理论上人畜无害。当然以前讲过多次这在实践中要复杂很多,ADC与化疗比MTD并未提高很多。
二是因为上面提到的肿瘤组织结构原因导致能穿过前门进入到肿瘤细胞的化疗药物只是达到肿瘤组织药物的一小部分。ADC药物因为可以利用与抗原结合的自用能,所以与化疗药物比较到达肿瘤组织ADC药物会有更大比例进入到外层肿瘤细胞、增加向肿瘤内核扩散药物的有效浓度。有时候抗体结合力太强会产生所谓的结合点障碍难题(binding site barrier),即ADC药物被扣留在离血管比较近的抗原阳性细胞、影响了ADC(不是毒素)向肿瘤内部的分布。解决这个问题可以通过降低一点ADC抗体亲和力或用不携带毒素的抗体去消耗一些抗原结合位点来实现。
三是同样摩尔数进入肿瘤细胞的ADC药物分子和小分子毒素产生的旁观者杀伤能力不同,因为每个ADC携带不止一个毒素、如Enhertu携带8个毒素,而化疗药物没有这个一变八的能力。尽管有旁观者杀伤能力的毒素卸载后因为过膜性比较好会快速逃离肿瘤细胞,但逃离方向是随机的。有的回到血液循环,有的则进入肿瘤深处。所以即使在部分肿瘤细胞短暂富集了毒素,也会增加小分子毒素自己通过扩散、对流很难覆盖区域的药物暴露,因此提高疗效。当然面向间质和面向肿瘤内核肿瘤细胞膜也可能有不同性质,当这方面信息有限。
上调外排泵是肿瘤对抗化疗打击的一个主要耐药机制,但外排泵抑制剂目前在临床试验中尚未显示能缓解化疗耐药。这是个复杂问题,但一个可能是抑制外排泵会减慢进入肿瘤细胞的药物向边远地区扩散、降低药物的肿瘤渗透。如下图所示,阿霉素(蓝色)加入外排泵抑制剂valspodar后虽然靠近血管(红色)区域分布提高,但据作者说远离血管区域反而有所下降[3]。
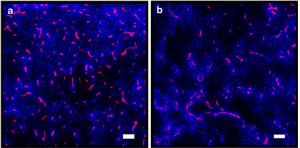
因为上面提到的ADC富集优势,肿瘤通过外排泵对抗ADC释放的毒素会面临更复杂后果,因为这可能比化疗药物更有效帮助毒素的肿瘤渗透、加剧旁观者杀伤效应。当然没有旁观者杀伤效应的ADC不存在这个问题,T-DM1耐药研究显示上调ABC转运蛋白可能是个因素。但依靠旁观者杀伤的T-DXd临床耐药机制研究DAISY试验并未提及任何外排泵的问题,只是观察到HER2下调和DNA修复机制上调。当然ADC耐药研究还在早期,期待以后会有更全面可靠数据。
[1] Sindhwani, Shrey, et al. "The entry of nanoparticles into solid tumours."Nature materials 19.5 (2020): 566-575.
[2] Dewhirst, Mark W., and Timothy W. Secomb. "Transport of drugs from blood vessels to tumour tissue."Nature Reviews Cancer 17 (2017): 738-750.
[3] Yu, Man, Alberto Ocana, and Ian F. Tannock. "Reversal of ATP-binding cassette drug transporter activity to modulate chemoresistance: why has it failed to provide clinical benefit?."Cancer and Metastasis Reviews 32 (2013): 211-227.
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源