
今天FDA批准了第一三共和阿斯列康的HER2 ADC药物Enhertu (通用名fam-trastuzumab deruxtecan-nxki,中文暂时译为嗯HER2)用于HER2阳性、至少接受两种HER2疗法的晚期乳腺癌患者。
Continue reading …
今天诺华宣布将终止从Aduro收购STING激动剂ADU-S100的开发,主要是与诺华自己的PD-1抗体spartalizumab、与施贵宝Yervoy的组合疗法开发,
Continue reading …
今天美国联邦贸易委员会(FTC)宣布经过10个月调查,没有证据表明罗氏收购Spark会减慢或终止Spark的A型血友病基因疗法的开发,也不会影响罗氏自己F8模拟物、双特异抗体Hemlibra的可及性。FTC惊奇地发现Spark只是开发血友病基因疗法公司之一,这个收购不仅不会减慢这些药物的开发、反而因为与其它厂家竞争会加速。
Continue reading …
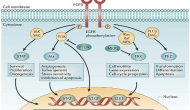
今天AZN和三共在SABCS年会上公布了其HER2 ADC药物trastuzumab deruxtecan (DS-8201)的一个叫做Destiny-Breast01的二期临床结果。这个单臂试验招募184位对已有HER药物、包括罗氏ADC药物Kadcyla耐药的HER2阳性乳腺癌患者
Continue reading …
今天制药巨头赛诺菲新掌门人Paul Hudson宣布了其执政纲领,主要战略变更是退出糖尿病、心血管疾病的研发,因此将节省约22亿欧元的研发开支。已经上市产品将并入通用药物部门,按成熟产品经营。
Continue reading …
今天Sage宣布其GABA受体阳性调控剂Sage217(又名Zuranolone)在一个叫做Mountain的三期临床失败。这个试验招募581位重症抑郁(MDD)患者,
Continue reading …
今天Aurinia宣布其环孢素衍生物voclosporin在一个增生性狼疮肾炎(LN)三期临床达到所有一级、二级终点。这个叫做AURORA的试验招募357位LN患者,在霉酚酸酯和低剂量甾体激素背景上分别使用voclosporin和安慰剂,一级终点位52周肾应答率。
Continue reading …
今天Incyte宣布FDA接受了其FGFR抑制剂pemigatinib在FGFR2融合或易位晚期胆管癌二线以后治疗的上市申请。在一个叫做FIGHT-202的二期临床试验中pemigatinib在这个人群产生36%应答率、中位应答时间为7.5个月。
Continue reading …
今天麻省总医院和哈佛大学科学家在《Cell Reports》发表一项工作,评价老药色甘酸钠在SOD1变异(G93A)驱动小鼠ALS模型的疗效。作者发现腹腔注射色甘酸钠可以显著推迟ALS症状出现(20小鼠天,相当于人的10年)、增加小鼠肌肉功能(根据一个叫做PaGE 的指标)、并延长雌性小鼠寿命(但对雄性无影响)。表征上色甘酸钠缓解肌肉去神经、改善运动神经元生存、并降低炎症细胞因子水平。
Continue reading …
今天FDA批准了Global Blood Therapeutics, Inc. (GBT)的小分子镰刀细胞疾病(SCD)药物Oxbryta (通用名voxeloto,曾用名GBT440) 用于12岁以上患者的治疗。
Continue reading …
今天在亚洲ESMO年会上加拿大生物技术公司Zymeworks与合作伙伴百济神州公布了其HER2双特异抗体ZW25的一个晚期实体瘤一期临床结果。这个试验招募69位晚期HER2表达非乳腺癌实体瘤患者
Continue reading …
Alnylam的Givosiran(商品名Givlaari)今天被FDA批准用于一种叫做急性肝卟啉病(AHP)的超级罕见病,成为第二个在美国上市的RNAi药物。这个批准是根据一个叫做ENVISION的三期临床试验,
Continue reading …
今天Bloomberg News报道诺华可能收购开发PCSK9 RNAi药物inclisiran的Medicines Company,令今天MDCO股票上扬20%。
Continue reading …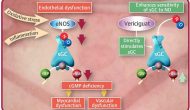
今天默沙东与合作伙伴拜耳宣布其心衰药物、可溶性鸟苷酸环化酶(sGC)激动剂Vericiguat在一个叫做VICTORIA的国际多中心三期临床试验达到由心衰住院和心血管死亡组成的复合一级终点。
Continue reading …






















 微信号:美中药源
微信号:美中药源