要闻点评2013-1-29:中外制药向日本监管部门申报抗体药物偶联物(ADC)T-DM1
作者:朱贵东
【新闻事件】:据东京消息,中外制药(Chugai Pharmaceutical)今天向日本卫生、劳动和福利省(MHLW)递交了抗体药物偶联物(ADC)trastuzumab emtansine(T-DM1)的新药申请(NDA),用于治疗人类表皮生长因子受体2(HER2)阳性的转移或复发性乳腺癌。该新药申报基于一个在日本之外进行的三期临床实验(EMILIA)和一个在日本本土进行的二期临床实验结果。前者代号为EMILIA的国际性三期临床实验头对头比较T-DM1单独用药与lapatinib(拉帕替尼)和capecitabine(卡培他滨)联合用药,用于治疗转移性或不可切除的局部晚期乳腺癌的疗效。这些乳腺癌患者都是HER2阳性,并且之前接受过曲妥珠单抗和紫杉醇化疗治疗。该临床实验注册有991位乳腺癌病人,其中不包含日本患者。无进展生存期(PFS)和总生存期(OS)是这个临床实验的主要观察终点。结果发现,T-DM1治疗组的无进展生存期的中位数达到9.6个月,和拉帕替尼/卡培他滨联合用药组的6.4个月相比延长了35%,并且具有统计学有效。T-DM1治疗组患者的总生存期和联合用药组相比也有显著延长,从25.1个月增加至30.9个月,死亡风险降低32%。不仅如此,T-DM1治疗组发生三级以上的严重不良反应的比率(41%)也较联合用药组低(57%),而且还能够避免许多典型的细胞毒素药物的副作用。然而,T-DM1组患者的血小板减少症的发生频率更高,当对药物剂量进行修饰后,绝大多数患者能够继续治疗。在日本进行的二期临床实验的药效和耐受性基本上和EMILIA实验相同。
【相关事实】:
• 在所有乳腺癌患者中大约有百分之二十人类表皮生长因子受体2(HER2)呈阳性。
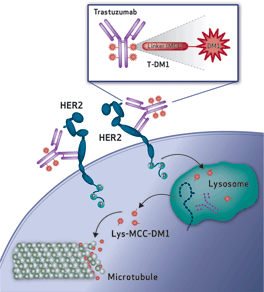
• Trastuzumab(曲拓珠单抗)是靶向HER2的单克隆抗体,T-DM1是把曲拓珠单抗和DM1采用ImmunoGen的稳定型连接子连接而成。
• 之前,罗氏和基因泰克公司已经向美国FDA递交了T-DM1的生物制剂许可申请(BLA),向欧洲EMA递交了上市申请。美国FDA已经授予T-DM1的优先审查资格,并定于2013年2月26日给予答复。
• 2010年FDA曾拒绝了罗氏和基因泰克公司递交的Trastuzumab-DM1(T-DM1)的生物制品申报(BLA)的加速审批。
• Dako HercepTest抗体与HER2 FISH pharmDx检测试剂将作为T-DM1的搭配诊断试剂。
【药源解析】:T-DM1是到目前为止第三个申报上市的抗体药物偶联物(ADC)。Mylotarg(Gemtuzumab Ozogamicin)于2001年被美国FDA批准有条件上市但附带黑框警告,因为副作用于2010年撤市。西雅图遗传的Adcetris的上市才真正展示ADC类药物的成功,推动了全球抗体药物偶联物研发的高潮,到目前为止至少有39个ADC药物处于不同的临床实验阶段。
结构上T-DM1把基因泰克公司的HER2靶向抗体trastuzumab采用ImmunoGen公司的TAP专利连接技术连到高活性抗有丝分裂化合物DM1上。罗氏公司在2010年曾基于T-DM1的二期临床实验结果向美国FDA提出上市申请,但被拒绝。FDA专家认为T-DM1申报的临床试验结果因为既没有包括HER2的检测也没有包括和目前标准疗法的直接比较,不能满足FDA加速审评的要求。
发表在2012年11月8日《新英格兰医学杂志》上的T-DM1三期临床实验结果证明,T-DM1和拉帕替尼/卡培他滨联合用药组相比显示明显优势,有望成为人类表皮生长因子受体2(HER2)阳性乳腺癌的一线疗法。
另外,EMILIA三期临床所证实的T-DM1的药理学特征也值得重视。肿瘤病理切片以及之前动物模型试验中的数据显示,对曲妥珠单抗治疗产生抵抗性的患者人群中HER2受体数量和功能均未受到损伤性影响。内脏转移灶肿瘤的消退指明,释放的细胞毒 maytansinoid在细胞内的聚集浓度足以导致细胞因有丝分裂障碍而死亡,并且没有出现曲妥珠单抗单药治疗时经常发生的肿瘤生长迟缓(cytostasis)。这样,T-DM1和设计原理完全相同,既保留了曲妥珠单抗的作用之外又增加了潜在的细胞毒素药物的效应。
【未来影响】:如果不出意外,T-DM1应该在短期内在美国、日本和欧洲上市。T-DM1的成功至少在两方面表现重要意义:(一)Mylotarg和Adcetris都是靶向血液肿瘤细胞表面抗原(CD33和CD30),到目前为止显示明显疗效的临床实验也局限于血液肿瘤。而T-DM1是靶向固体肿瘤细胞。理论上讲,固体肿瘤组织更复杂,给ADC药物的渗透造成更多困难;(二)T-DM1的接头是由稳定的硫醚健连接,被肿瘤细胞吞噬后释放了仍然带有接头片段但具有同等活性的美登素细胞毒,同时也表明这类ADC药物在细胞外没有释放细胞毒。T-DM1明显的临床疗效证明,细胞内或细胞表面裂解接头不是ADC药物设计的必要条件,但其对各类肿瘤细胞的广谱性有待确认。
【药源相关报道】(因网站文章整理进行中,以下链接会尽快补上,敬请谅解)
要闻点评2013-1-24:西雅图遗传和千禧制药启动Adcetris的又一个三期临床,治疗表达CD30的成熟T-细胞淋巴瘤(MTCL)
药源点评2012-12-21:抗体药物偶联物(ADC)
Synthon生物制药公司的抗体药物偶联物(ADC)在临床前实验中显示积极疗效
★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源