从挑战替诺福韦专利案谈仿制药开发策略和民族工业保护
作者:吕顺
富马酸替诺福韦脂(简称替诺福韦,英文名:Tenofovir Disoproxil Fumarate,商品名:Viread)由美国吉利德(Gilead)制药公司开发,是一种核苷酸类抗病毒药。替诺福韦能有效地抑制在人类免疫缺陷病毒1(HIV-1)和B型肝炎病毒(乙肝)感染中起关键作用的逆转录酶的表达,在2001年和2008年分别被经美国FDA批准用于治疗HIV感染和乙肝。替诺福韦是多个治疗指南推荐的艾滋病一线药物。另外,鉴于其明显优于传统乙肝药物,替诺福韦也逐步成为一线抗乙肝用药。替诺福韦在2008年6月18日获得中国SFDA的药品进口注册证,以商品名替诺福韦酯片(300毫克/片)在中国销售,2010年的全球销售额超过60亿美元。
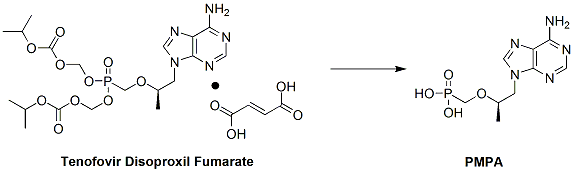
如上图所示,替诺福韦是核苷酸类抗病毒化合物PMPA的前药,其有效活性成分PMPA由捷克化学家Antonín Holý和比利时生物学家Erik De Clercq共同发现,并在1985年申请了专利。因为PMPA本身不稳定,而且在人体内吸收差,具有极低的生物利用度,所以临床上没有被进一步开发。吉利德公司随后收购了Holý和De Clercq包括PMPA在内的多个核苷酸化合物的专利权,并在此基础上进行分子结构改造,引入生物可降解的碳酸酯,使 PMPA的稳定性和药物动力学特征得到有效的提高,开发了替诺福韦以及最终富马酸盐制剂。替诺福韦及相关化合物在大部分发达国家获得化合物、包括富马酸在内的制剂、晶型和用途的专利授权,美国专利号为别为 5,922,695(替诺福韦脂化合物)、5,977,089(手性化合物)、5,935,946(富马酸盐制剂)、和 6,043,230(用途)。专利有效期至2017年。
替诺福韦专利诉讼案
公共专利基金会(Public Patent Foundation,简称:PubPat)是一个以健全专利制度,特别是消除因错误的专利授权而损害公众利益为宗旨的公益性组织。PubPat在2007年3月向美国专利商标局呈递材料,论证在吉利德最早的“695”专利申请之前,PMPA的相关前药已经被披露,要求重新审议吉利德和替诺福韦相关的所有四项专利的有效性。
吉利德的“695”专利在1997年7月25日申报,是临时专利申请(Provisional Patent Application,No. 60/022,708)的部分连续申请(continuation-in-part),其优先权日是“708”专利的递交日期1996年7月26日。PubPat发现“695”专利和“708”专利权利要求陈述的化学结构通式不同,不符合美国专利法案35 U.S.C. § 112条款的要求,因此,“695”专利的优先权日期应该是其申报日1997年7月25日,而不是临时专利“708”的申请日。而Bischofberger早在1997年1月已经报道了PMPA的碳酸酯前药能有效地提高PMPA的生物利用度(Bischofberger et al. “Bis(POC)PMPA, an Orally Bioavailable Prodrug of the Antiretroviral Agent PMPA” Conference on Retroviruses and Opportunistic Infections, 4th:104 (abstract no. 214) (January 22-26, 1997)),该会议报告和吉利德“695”专利申报的权利要求高度一致。所以吉利德“695”和相关专利的申报主题都是已知的,不具备专利性。
2007年7月,美国专利商标局启动对吉利德替诺福韦专利的复查程序,并于2008年一月宣布相关的所有四项专利均无效。随后吉利德在法定时间内提交材料,证明关键的实验是在Bischofberger的文献报道之前完成,美国专利商标局经过审议后分别在2008年5月(6,043,230)、6月(5,922,695)和10月(5,977,089,5,935,946)重新认定这些专利的有效性。
在2008至2010年间,跨国仿制药巨头提瓦制药公司向美国FDA提交一系列简化新药申请(ANDA),申报生产并销售Viread以及相关复方药物(替诺福韦酯、替诺福韦酯+恩曲他滨及替诺福韦酯+恩曲他滨+依法韦伦)的仿制药,同时再一次挑战吉利德和替诺福韦相关的四项专利的有效性。按照美国Hatch Maxman法案,如果原研药公司在收到挑战后45天内回应,而且未收到法院的最终判决,可以防止仿制药在30个月内上市。2013年4月,吉利德就此四项专利案和提瓦达成庭外和解,允许提瓦在2017年12月生产并销售Viread的仿制版,并提交美国联邦贸易委员会批准。
除此之外,替诺福韦还在世界范围内受到包括印度、中国、巴西在内的各国仿制药公司的挑战。印度最大的仿制药生产商西普拉公司(Cipla)也对替诺福韦的专利发起无效申请,认为吉利德专利独创性不足。印度专利局已经接受了这一观点,从而否决了吉列德的专利申请。Cipla自2005年起已在印度以原研药八分之一的价格(每年700美元/患者)销售替诺福韦脂(商品名Tenvir)。在中国,吉利德公司在2008年得到CN100384859C和CN100383148C两个专利授权,分别保护了替诺福韦酯化合物、富马酸替诺福韦酯盐及其晶型,专利至2017年和2018到期。上海奥锐特制药公司也向国家知识产权局专利复审委员会提交了吉利德专利的无效申请。奥瑞特认为“吉利德专利本身有很大的缺陷,其核心的活性成分PMPA为早先已知公开的抗病毒母核,吉利德公司只是外加了一些辅助吸收的成分,不足以得到专利保护”。目前专利复审委员会已经同意奥瑞特公司的申请,判定吉利德专利无效。吉利德公司已经提出上诉,笔者对最后判决结果将拭目以待。
药源点评
笔者认为,以上反反复复的替诺福韦专利案是值得所有从事药物研发领域的管理和研究人员关注的一个典型案例,从多个侧面阐述了从知识产权保护到产品开发思路多个领域值得注意的问题。首先,吉利德专利案说明,无可争议的知识产权是开发一个新药的先决条件。当然,无可争议也是相对的,是指在最大限度下根据现有掌握的信息而未发现任何争议的专利区域。新药开发的知识产权保护分为专利授权(Issued Patent)和自由实施(Freedom To Operate,简称FTO)两个方面,前者指明专利的可能归属,而后者说明潜在的侵权风险。以上替诺福韦专利案还表明,一个专利申请得到国家专利职能部门的批准并不代表拥有该专利的最终授权,如果产品开发失败,不会有人浪费资源去研究该产品的侵权问题,而象替诺福韦一样产品开发的成功将会遇到来自包括PubPat和仿制药公司等多方面的挑战,最高法院的最终判决才是决定一个专利所有权的最终归属。所以,尤其对于那些即将走出中国的制药集团在临床开发一个产品之前要充分评估知识产权归属,通过充分的专利和出版物检索,在最大程度上判定专利归属和侵权风险。
其次,专利作为一种无形资产,其新颖性、创造性、以及充分性的评判常常会出现模糊地带。显然,前药的创新程度通常低于全新结构的活性化合物本身,其可专利性和申报的年代、申报的国家、特别是前药的成药效果相关。比如,在九十年代之前,前药和手性化合物获得专利的机会较大,但随着时间的推移,化合物专利通常包含并覆盖常见前药、手性化合物甚至还有同位素标记化合物等,所以常见的前药获得专利授权的机会非常小。而罕见的前药包括含有靶向性等特殊设计目标的分子依然具有可专利性。比如多数的抗体药物偶联物也是前药。其次,和其它国家相比,美国的专利授权更注重申报主体自身的创新性和其特征的不可预见性。中国国家知识产权局对专利主题的性能要求更全面,而印度则明文规定包括脂等常见前药不具可专利性。除此之外,每个国家都会在不同程度上有保护民族企业的倾向,在评估专利诉讼的结果时也是重要的影响因素之一。第三,前药的成药效果也是可专利性的关键。比如常见前药设计通常能在一定程度上优化母核化合物的包括口服生物利用度等成药特征,但毕竟是极少的前药修饰能有效地优化母核化合物包括稳定性、生物利用度、毒性等所有的成药效果。前药的设计只是众多分子结构优化的一个手段,但不是优化成药特征的充分条件,也就是说一些前药修饰的结果有较高的不可预见性。
以替诺福韦专利案为例,笔者以为PubPat对吉利德替诺福韦专利挑战的重点是在两个技术层面,一个是“695”专利和“708”专利的结构通式不符,导致“695”专利的优先权日的推迟,另一个是Bischofberger等人的报道在“695”专利申报之前。虽然PMPA早已公认,但其最大的特点是不稳定性和不易吸收。吉利德通过前药设计解决了这些关键的成药性问题,在化学上属重大突破,有一定的不可预见性,这绝不仅仅是“外加了一些辅助吸收的成分”那么简单。除此之外,大部分化合物专利通常不覆盖含有一个碳酸酯的磷酸酯前药。
最后,根据以上分析,以美国专利授权相对而言更注重创新性,而中国专利也强调申报主题不可预见的性能为依据,再加上以往类似案例的判决对法官也会产生影响(比如辉瑞的伟哥专利案),以及这个案例的判决对将来类似案例判决的影响(比如直接导致对去年上市的1.1类新药阿利沙坦酯的专利诉讼),尽管目前国家专利复审委员会在替诺福韦专利案上已经支持奥瑞特公司的观点,判定吉利德专利无效。但笔者还是预计该案最终会以吉利德胜诉告终。
民族工业保护
民族保护主义至少从两个方面影响医药专利的授权。(一)医药是关系到民生的特殊商品。政府既要刺激企业的创新积极性,同时也要把药物价格控制在公民可以承受的范围。因为药品的主要成本来自开发投资,尤其对于小分子药物而言,生产成本在售价中占极小的部分。世界卫生组织因此要求药企对治疗诸如疟疾、肺结核和艾滋病等传染性疾病药物的定价要考虑当地的购买力,比如一部分抗逆转录病毒治疗药物在非洲能够以每年少于100美元的价格买到, 而相同药品在发达国家则要以高几十倍甚至上百倍。(二)药厂的最高追求归根结底还是巨额利润。和目前常用的乙肝药物干扰素和其它核苷类药物相比,替诺福韦脂因为疗效好,副作用小,价格相对合理而逐渐成为核苷类药物的后起之秀,其市场潜力非常诱人。据保守估计,替诺福韦国产化以后至少是一个10亿元人民币的市场。
印度是本土保护主义的典型。在印度除了专利授权的要求更苛刻以外,对部分适应症还推行“强制许可证”,允许当地公司忽视原研药公司的专利,生产并销售仿制药。比如今年1月,印度卫生部建议对曲妥单抗和其他两种癌症药物实行强制许可。在过去的3周里,印度官员拒绝了两个品牌乳腺癌药物的专利授权。7月27日,当地联邦专利委员会撤销了一份乳腺癌药物拉帕替尼的衍生物的专利申报。8月4日,印度国家专利系统的一个专利办公室公布不会对罗氏的曲妥单抗专利授权。
然而民族保护主义也是一把双刃剑,既可以把外企拒之门外,也有碍国企在国际市场的竞争力,流氓国家最终会被世界遗弃。比如,罗氏上周已经决定放弃在印度申报赫赛汀的印度专利(No. 205534)及相关的分案专利申请。罗氏公司声明:这次的决定考虑了特定权利的强度以及印度的知识产权环境。中国不同于印度,既有决心也有实力争雄世界。作为一个世界第二大的经济体,要想真正跻身于世界强国之列,必须制定和强国匹配的游戏规则。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源