要闻点评2013年11月3日:默克全口服MK-5172/MK-8742组合中期结果出炉,抗丙肝市场竞争日趋激烈
作者:吕顺
【新闻事件】据美国商业电讯消息,默沙东(Merck & Co)今天在第64届美国肝病研究协会年会(Washington D.C,Nov 1-5)上发布其全口服抗丙肝实验药MK-5172/MK8742组合的IIB期临床实验结果(C-WORTHY实验),用于治疗HCV基因1型初治患者、治疗失败的患者、以及其他重要的如肝硬化患者和HCV/HIV合并感染等HCV亚群。该二期实验还在进行,中期数据显示配服MK-5172/MK-8742连续12周后三个实验组中的两个到目前为止全部达到持续病毒学应答(SVR12)。
默克实验药MK-5172/MK-8742组合是一种全口服抗丙肝方案。前者是NS3/4A蛋白酶抑制剂,后者是HCV NS5A复制复合物抑制剂。这个C-WORTHY实验共注册65位丙肝患者,其中有效患者数为58位,分为三个治疗组:MK-5172(100毫克)/MK-8742(20毫克)和利巴韦林三联用药组由22位患者组成,MK-5172(100毫克)/MK-8742(50毫克)和利巴韦林三联用药组包括24位患者,MK-5172(100毫克)/MK-8742(50毫克)联合用药组只有12为患者。其中三联的低剂量用药组和MK-5172/MK-8742联合组12周后都取得百分之百的持续病毒学应答。而MK-5172(100毫克)/MK-8742(50毫克)和利巴韦林三联用药组有一位患者在随访的第4周和12周经历复发。检测到HCV RNA。该组合耐受性良好,常见不良反应包括疲劳(26%)、头痛( 22%)、恶心(18%)、腹泻(12% )、头晕(11%)和皮疹(11%)。所有患者都未有观察到三级或四级不良事件,而且也未有因耐受性引起的停药。根据该积极的初步实验结果,默克决定进一步扩展这个二期临床,总注册患者数将达400人。
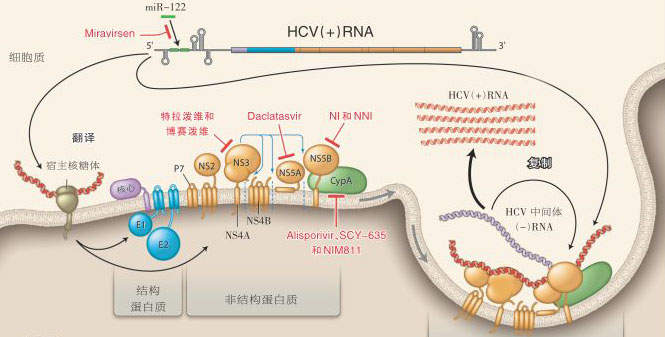
【药源解析】全球可能有高达1亿7千万人携带丙肝病毒,而仅美国就有4百万患者。所以丙型肝炎药物市场是一个大饼,估计到2020年规模可能达到250亿美元。HCV是一种正链RNA病毒,含有六个基因型。如上图所示,HCV病毒的结构蛋白由两种包膜糖蛋白和核心蛋白构成,非结构蛋白NS2、NS3、NS4A、NS4B、NS5A和NS5B与病毒RNA形成复合物,在一个细胞质膜性结构中启动病毒的复制。HCV主要感染肝细胞,并且具有一种神秘的、可以多种方式逃避宿主免疫应答反应的能力。
慢性丙型肝炎的治疗目标是清除病毒,从而可限制或防止并发症的发生,成功治疗的终点是持续病毒学应答,定义为已停止治疗后的24周时,血清中检测不到HCV RNA。到目前为止,抗HCV病毒感染的药物一部分直接作用于病毒靶点,而其它一些药物的靶点是对HCV复制至关重要的宿主蛋白。而对于所有丙肝亚型,聚乙二醇干扰素和利巴韦林联合应用依然是慢性丙型肝炎患者的标准治疗。应用这一方案,基因2或3型HCV感染患者可获得70%~80%的持续病毒学应答率,其他任何基因型的患者可获得45%~70%的持续病毒学应答率。
特拉泼维(telaprevir)和博赛泼维(boceprevir)是两种最早获批的NS3/4A丝氨酸蛋白酶抑制剂。从而使得HCV基因1型感染的治疗有了三联疗法,即将这两种蛋白酶抑制剂的其中一种与聚乙二醇干扰素和利巴韦林联合应用。这两种三联疗法方案的应答率相似,但在给药时机方面却差异很大。也未被批准用于除了基因1型以外的其他基因型HCV感染患者。而且尽管三联疗法方案比无蛋白酶抑制剂的聚乙二醇干扰素和利巴韦林方案更有效,但它们也有额外的副作用,治疗也相当复杂,还有许多药物相互作用的潜在问题。
10月24日,美国FDA抗病毒专家小组一致投票建议批准Medivir/强生旗下NS3/4A抑制剂Simeprevir上市。如果FDA遵循该建议,那么Simeprevir将成为美国上市的第三款丙型肝炎蛋白酶抑制剂。这款药物已于上个月在日本以Sovriad为商品名获得上市批准,而日本也是其全球第一个市场。和其它两款蛋白酶抑制剂一样,Simeprevir只适用于HCV 基因1型感染,需要与聚乙二醇干扰素、利巴韦林联用。之前开展的三个III期临床实验中,治疗组与对照组的SVR12分别为80%、50%;针对复发患者的HPC3007试验中,治疗组与对照组的SVR12率分别为79%、36%。Simeprevir的临床试验有4例患者死亡,但被认定与治疗无关,另外有0.4%的患者有严重不良反应(1例患者重性抑郁,2例患者有光敏反应),这被认定与使用simeprevir有关。
另一种可能更具潜力的抗丙肝靶点是NS5A聚合酶,它在装配细胞质膜-结合的复制复合物中起重要作用。目前,已经开发出多种包括核苷酸和非核苷酸类似物的NS5B聚合酶抑制剂。核苷酸抑制剂靶向保守核苷酸结合袋,是链聚合的终止剂。而非核苷酸抑制剂与NS5B的其它区域结合,是变构抑制剂。有近二十种的NS5B抑制剂处于处于不同阶段的临床实验中,其中吉利德的Sofosbuvir走在最前列,也是首个实现纯口服的抗丙肝药物,对于HCV 的基因2型和3型感染只需与利巴韦林联用,FDA专家小组也支持其联合聚乙二醇干扰素、利巴韦林用于HCV基因1型和4型感染。
Gilead已经开展了四项III期临床试验评价sofosbuvir的疗效和安全性。其中,Fission选择感染2或3型丙肝病毒病人,随机接受12周仿核苷酸药sofosbuvir与利巴韦林联合用药,或24周利巴韦林与聚乙二醇化干扰素联合用药(所谓标准疗法)。治疗结束时两组病人都达到了67%的持久性病毒学应答(SVR)。在POSITRON实验中,sofosbuvir和利巴韦林联合用药组对于干扰素耐药,基因2型和3型患者的 SVR12分别为93%、61%,而安慰剂对照组没有任何应答。在NeutrinoIII期实验中,基因1型,4,5或6丙型肝炎病毒感染的患者进行为期12周的sofosbuvir加利巴韦林与聚乙二醇化干扰素联合用药。治疗结束病人都达到了90%的持久性病毒学应答(SVR)。而预期的只用利巴韦林与聚乙二醇化干扰素联合用药的SVR率为60%。Sofosbuvir临床试验中未发现严重不良反应,最常见的副作用包括疲劳、头痛、昏迷、失眠和贫血。未出现因心脏副作用停药。吉利德于2013年4月提交了sofosbuvir的新药申请(NDA),FDA于2013年6月授予sofosbuvir NDA优先审查资格。Sofosbuvir NDA所包含的数据,支持了将sofosbuvir与利巴韦林(RBV)作为一种全口服疗法用于基因型2型和3型HCV感染的治疗,以及将sofosbuvir与利巴韦林、聚乙二醇干扰素(PEG-IFN)用于基因型1型、4型、6型HCV感染的治疗。
尽管波西普韦与特拉普韦均对丙型肝炎的治疗产生了巨大的影响,提高了以干扰素为基础治疗方案的有效性,并快速进入市场,但必须与干扰素和联用。干扰素需要注射而利巴韦林有严重的感冒状副反应,加上治疗时间较长(5个月以上),所以病人负担很重。而目前包括sofosbuvir在内的在研全口服、无利巴韦林组合疗效更好,使用更方便,副作用远小于波西普韦或特拉普韦/干扰素/雷巴威林组合。10月25日,美国FDA抗病毒药物专家小组公布了投票结果,支持吉利德的sofosbuvir上市。虽然FDA咨询委员会不代表FDA,但也标志着Gilead基本完成最后冲刺,如果没有意外,今年年底会推向市场。其它蛋白酶抑制剂类药物包括勃林格殷格翰的Faldaprevir,默沙东的Vaniprevir,百时美施贵宝的Asunaprevir,以及雅培生命的ABT 450与第一代抗丙肝药物相比也有优越的病毒治愈率和更温和的副作用。和sofosbuvir相比也只有一步之遥。因为sofosbuvir的疗效并未完全达到业界的预期,要保持其领先地位,占领绝大部分的市场份额还需继续努力。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。
★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源