诺华Zykadia(ceritinib)是首个采用中期临床结果申报并获得FDA批准的“突破性药物”
作者:吕顺
【新闻背景】4月29日,美国FDA通过加速审批通道(accelerated approval)批准了诺华的二代ALK抑制剂Zykadia(通用名:ceritinib,代号:LDK378)上市,用于治疗Xalkori(Crizotinib Capsules,克唑替尼胶囊)治疗失败或不能耐受的ALK阳性的转移性非小细胞肺癌(NSCLC)患者。Zykadia是继辉瑞的Xalkori之后获得美国FDA批准上市的第二个ALK抑制剂,也是首个采用中期临床结果申报并获得FDA批准的“突破性药物”,比FDA预期的批准时间提前了4个月。
【药源解析】美中药源在2月2日曾经报道,诺华充分利用了ceritinib获得美国FDA“突破性药物”资格带来的优惠,在得到三期临床结果之前,直接采用中期的临床数据申报上市(NDA)。事实证明,这个策略再一次获得成功,而且还比FDA完成药物评审的预期日期2014年8月24日,即处方药用户付费目标日期提前了4个月。Ceritinib是自FDA在2012年开始推行“突破性药物”评审以来获得批准上市的第四款“突破性药物”,是第一个采用中期临床结果申报并获得FDA批准的“突破性药物”。其它三个获得FDA批准的“突破性药物”分别是Gazyva、Imruvica和Sovalldi,但这些都是通过积极的三期临床结果才获得FDA批准的。
Ceritinib是每天一次口服的胶囊剂,推荐剂量为750毫克/天。支持这次FDA申报的二期临床实验招募了163例crizotinib耐药或不耐受的患者,总应答率(ORR)为54.6%,其中包括1.2%的完全应答和53.4%的部分应答,持续应答时间为7.4个月。不良反应包括胃肠道副作用(腹泻、恶心、呕吐、腹痛)、肝毒性、间质性肺病、QT间期延长、高血糖、心动过缓、以及胚胎胎儿毒性等。
发现优质的分子靶点是现代医药工业的关键,也是新药开发的最大瓶颈。EML4-ALK和NPM-ALK融合蛋白是近年来发现的为数不多的确认靶点之一。但是ALK阳性的患者比例较低,只占非小细胞肺癌患者总数的4-5%,而且在2011年美国FDA已经批准了辉瑞的Xalkori上市。即使如此,还是有很多药厂跟进,目前至少有6个在研项目处于临床开发阶段。这些以ceritinib为首的二代ALK抑制剂主要针对那些对Xalkori耐药或不能耐受的晚期非小细胞肺癌患者。诺华为了争得二代ALK抑制剂的首创地位,利用了FDA能给予的所有优势,包括“突破性药物资格”(Breakthrough Therapy designation)、优先评审(Priority Review)、加速批准(accelerated approval)和孤儿药资格(orphan drug designation)。并成功地通过中期临床结果申报上市,且比处方药用户付费目标的日期提前4个月。
笔者以为Xalkori和Zykadia是创新药和已知机理新药开发的两个典型。前者的立项依据是显然的,代表着个体化治疗的重大突破。而后者也解决了前者耐药或不能耐受的关键问题,符合支付方支付高额药价的要求。虽然ALK阳性的非小细胞肺癌患者在美国不足1万例,考虑到高达十数万美元的药价,Xalkori的销售峰值会接近10亿美元,而Zykadia也能得到前者一半的销售额。
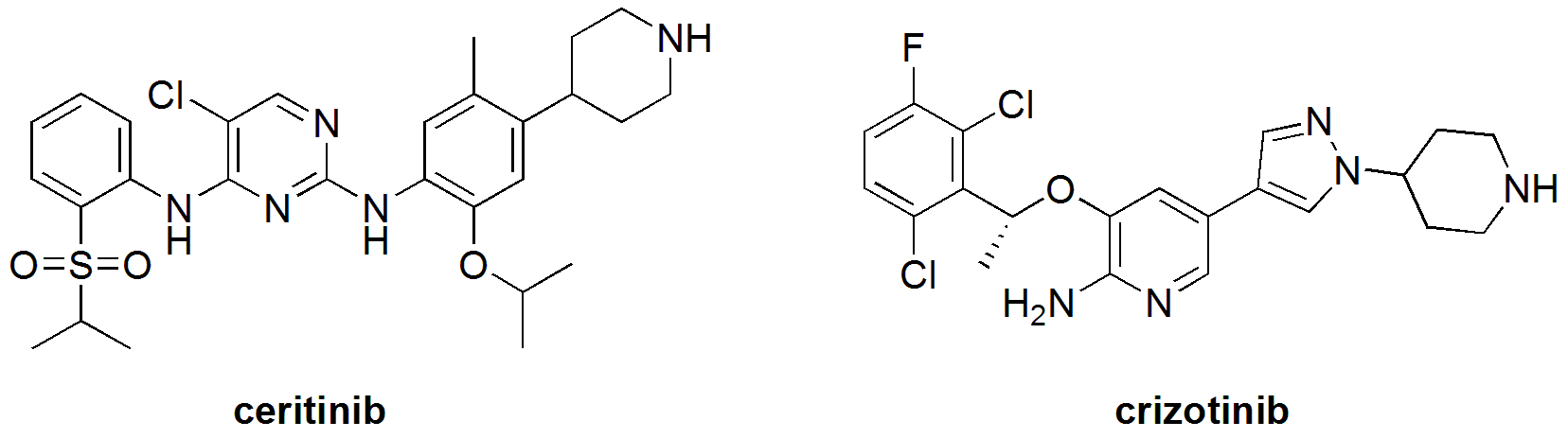
开发共价键/不可逆抑制剂是克服蛋白激酶抑制剂耐药的一个常见手段。但是ceritinib和克唑替尼(crizotinib)一样,是可逆性的间变性淋巴瘤激酶(ALK)酪氨酸激酶抑制剂,在细胞内能选择性地抑制EML4-ALK和NPM-ALK融合蛋白的表达。如下图所示,虽然这两个化合物在化学结构上有较大差别,但抑制ALK的模式应该类似,所以到目前为止还不清楚ceritinib避免耐药的分子机理。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★




















 微信号:美中药源
微信号:美中药源