从基因的角度解析心血管疾病风险(一)从肝脏到心脏
By 沈骊 GB HealthWatch

引言:我们也许已经多次听说过这样的悲剧,正当年富力强的男人,在毫无预兆的情况下,突然发生心肌梗塞离世,给父母妻儿以及亲朋好友们留下无比的伤痛和遗憾。然而对于家族中有过类似经历的人,震惊和惋惜既不能挽回亲人的生命, 也不能杜绝悲剧的再次发生。如果我们今天不以科学为武器,而是听天由命,那么同样的悲剧可能继续在我们自己和我们的下一代身上发生。所幸的是,现代医学已经逐渐揭开造成心肌梗塞和其他心脑血管疾病的致病机制和遗传因素,而且已经有了又好又安全的药物能够有效的降低疾病风险。如果我们能做到早诊断早预防早治疗,悲剧在很大程度是可以避免的。这篇科普文章通过解析心血管疾病的风险基因,向读者展示基因,血脂,血压,饮食和生活习惯等因素是如何相互作用,参与动脉粥样硬化的形成和发展,最终导致心血管疾病的发生。并且从精准医学和营养学的角度探讨如何保护好我们自己,力争健康长寿。本文共分五章:(一)从肝脏到心脏;(二)细说胆固醇;三)没人能逃避的动脉粥样硬化;(四)遗传组合;五)精准医学和营养学。
第一章:从肝脏到心脏
心肌梗塞看似突然发病,其实发病前患者的血管早就因为动脉粥样硬化出现了狭窄区域。我们一般会以为动脉粥样硬化是老年人的病,其实从我们出生那天开始,粥样硬化就一点点开始在我们的动脉血管上发生。天长日久,随着年龄的增加,越来越多的动脉血管区域变得狭窄,这时如果一个偶然事件触发血栓形成,血栓刚好堵塞了冠状动脉的狭窄处,就会导致心肌缺血缺氧,急性心肌梗塞会不期而至。虽然动脉粥样化硬化在我们每个人身上都会发生,谁也逃不脱,但是个体之间差异很大。一小部份人在三四十岁时他们的冠状动脉就已经变得很狭窄,随时可能触发心肌梗塞;而另一小部份人活到一百岁,血管仍然很畅通;而我们中的大多数则在两个极端之间。一个人如果不得癌症,其寿命的长短很大程度取决于动脉血管的干净畅通程度,如果能有效减缓动脉粥样硬化的速度,就有可能延长寿命。确实,他汀类降胆固醇药物的普遍使用是近三十年来人类平均寿命显著增加的最要重原因。基因,性别和饮食是三个决定动脉粥样硬化进程主要的因素。

图1. 心肌梗塞, 男性比女性发病更早发病率更高
基因惹的祸
每当听说某公众人物突发心脏病死亡,大家首先会责怪饮食不健康,锻炼不够,或者是工作压力太大,没有注意休息等生活因素。然而如果心肌梗塞发生在40-50岁的壮年男人身上,那么基因就多半是罪魁祸首。其实我们可能已经注意到,不少早发心肌梗塞的人,通常体质看起来很棒,饮食和生活习惯良好,有的还是体育达人,如果没有心肌梗塞事件,他们自己以及外界都会误以为他们身体很棒。为什么一些看起来很 “健壮” 的男人会在正当壮年的年龄突发心血管事件呢?答案是基因惹的祸。在基因面前,从来都不是人人平等。要想躲过基因惹的祸,就必须对基因如何导致疾病有完整深入的理解,才有可能制作针对惹祸基因的预防和治疗措施,才有可能争取在健康长寿上的平等。
肝脏,心血管疾病风险基因集中地
心血管疾病看似发病位置在心脏,出问题的基因却主要在肝脏表达。己知的与早发心肌梗塞风险密切相关的基因包括LDLR, APOB, PCSK9,APOE, LPA, APOA1, ABCA1 和SCARB1等,前面六个基因主要在肝脏表达,而后面两个基因则主要在肝脏,巨噬细胞和内分泌器官中表达。无一例外这些基因都与胆固醇的运送,回收和清除有关。我们在稍后还会讲到用于预防和治疗心血管疾病的药物他汀类和PCSK9抑制剂等作用靶点也在肝脏。
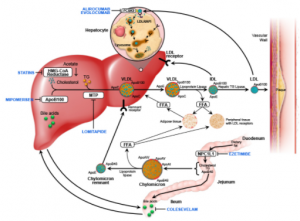
图2. 肝脏是心血管疾病风险基因的集中地。LDLR, APOB, PCSK9, APOE, LPA, SCARB1 和APOA1都主要在肝脏表达, 这些基因负责胆固醇在身体中的运送回收和清除,因此影响血液和处周组织中胆固醇的浓度,进而影响动脉粥样硬化的进程。最主要的降胆固醇药物他汀类和PCSK9抑制剂药物靶点都在肝脏,都是通过增加细胞膜上LDLR的量以促进肝脏对血液中胆固醇的回收而起作用。另外的两个降胆固醇药则通过抑制肠道吸收胆固醇。
我们已经知道动脉粥样硬化是绝大多数心血管疾病的起因和前奏。而动脉粥样硬化病理过程最相关的生物通道则以胆固醇为核心,牵涉到胆固醇从肝脏-血液-组织之间的运送回收。如果一个人携带风险基因,一般会从三个血液检测指标中反应出来,它们分别是:1)低密度胆固醇 (LDL-C);2)高密度胆固醇(HDL-C);3)脂蛋白a (Lp(a))。前面两个指标大家已经很熟悉,每年体检都会检查。而第三个指标,Lp(a)是一种还不太普极,但已经开始成为心血管病专科的热门血液检测指标。美国专科医生会给血肌梗塞高危病人开Lp(a)检查,特别是对那些胆固醇水平并不高但相对年轻就已经发生心肌梗塞的病人。
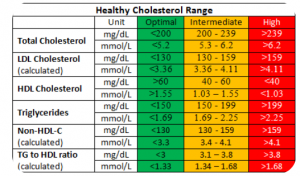
图3. 血脂检查中的胆固醇指标
低密度胆固醇LDL-C
第一个血液指标LDL-C,也就是我们通常说的 “坏”胆固醇。LDL-C主要反映肝脏回收血液中胆固醇的能力,如果这个通道上有基因缺陷会表现为高胆固醇血症,即LDL-C水平严重升高。理想的LDL-C浓度应该小于100mg/dL, 小于130mg/dL被定义为正常范围,如果高于190mg/dL,就被临床诊断为高胆固醇血症。携带有家族性高胆固醇血症基因(familia hypercholesterolemia, FH)突变的人,从年轻时胆固醇就比一般人高很多,血管因此长期暴露在高胆固醇环境中,这些人四五十岁就可能出现严重动脉粥样硬化和突发心肌梗塞事件。最常见导致家族性高胆固醇血症的基因是LDLR, APOB和PCSK9,其中约90% 的FH病人携带LDLR突变,5%携带APOB突变,小于1%有PCSK9突变,另外3-4%发生在其他基因上。LDLR编码低密度脂蛋白LDL受体,负责将血液中的LDL微粒转运进入细胞。如果LDLR基因发生突变使肝脏回收LDL微粒降低,LDL微粒就会滞留在血液中,由它运载的胆固醇LDL-C就会升高。APOB编码组成LDL微粒的核心脂蛋白apoB100, apoB100上的受体结合区域通过与LDLR嵌合促使血液中的LDL微粒进入肝脏被回收。如果APOB基因受体结合区域发生突变,同样会造成血液中LDL-C升高。最后PCSK9编码一个酶负责LDLR的循环使用,如果这个酶活性太高,LDLR不能循环回到细胞膜表面,也就降低了肝脏回收血液中LDL微粒的能力,LDL-C就会升高。任何原因造成的LDL-C升高都会加速动脉粥样硬化的进程和增加心血管病风险。我们将在第二章详细介绍LDL微粒的组成和它在胆固醇供应链中的作用。
家族性高胆固醇血症
家族性高胆固醇症 (FH) 是目前研究得最多与心血管病相关性最强的遗传病。主要症状为血液中LDL-C浓度很高,而且是从年轻时侯就高。在没有使用降血脂药物情况下,LDL-C超过190mg/dL (4.9 mmol/L), 并且有家族史就要考虑是FH。基因检测是确诊FH的黄金标准(gold standard) 。FH如果没有被早期诊断和治疗,男性在55岁以前,女性在60岁以前突发心肌梗塞或其他缺血性心脑血管疾病的风险可以高达普通人的二十倍。很愦撼,即使在医疗发达的美国,90%以上的FH仍然没有被正确诊断和治疗。绝大多数FH是在心肌梗塞发生后才被诊断。然而,FH导致的早发心肌梗死是可以预防的。通过基因检测早期确诊的FH患者,如果从青少年时期就开始采用降胆固醇药物治疗,可以让心血管病推迟10-15年。
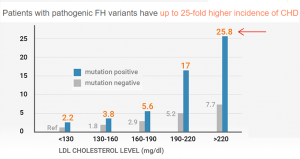
图4. 家族性高胆固醇血症 (FH)患者的胆固醇水平与对应的心血管病风险。在相同胆固醇水平下,携带基因突变(mutation positive)比没基因突变(mutation negative)风险要大很多。
高密度胆固醇HDL-C
第二个血液指标HDL-C,也就是说我们常说的“好”胆固醇。HDL-C的浓度部份反映机体清除处周组织中过剩胆固醇的能力,又称为胆固醇反转运通道(cholesterol reverse transport)。这个通道上的基因缺陷可以表现为HDL-C浓度过低也可以表现为HDL-C过高。多数情况下HDL-C浓度高表明反转运机制运行良好,心血管病风险降低。胆固醇反转运是一个比较复杂的过程,参与反转运的基因也很多,包括APOA1, ABCA1, LCAT, LIPC, LIPG, CETP, SCARB1等,发生在这些基因上的突变会影响机体清除细胞和组织中多余胆固醇的能力,包括沉积在血管壁上的胆固醇。女性的HDL-C总体比男性高,这也是女性不容易患心血管病的原因之一。雌激素会刺激APOA1基因表达,而APOA1基因在胆固醇反转运中扮演至关重要的角色。APOA1基因由肝脏表达,其编码的蛋白质apoA1是形成高密度脂蛋白HDL的核心蛋白。裸体的apoA1脂蛋白就像专门收集废品的小车,从肝脏出发随血液循环到外周组织各处收集多余或受损的胆固醇分子,并将它们打包运回肝脏。这些由apoA1收集运载的胆固醇就是HDL-C,即所谓的“好”胆固醇。其实“好”胆固醇并不是指胆固醇分子本身更好,而是越多的胆固醇分子被收集到HDL微粒上,说明外周组织中多余的胆固醇被清除得越干净。除了APOA1基因外,胆固醇反转运通道上的另一个重要角色ABCA1是一个分子泵,负责将胆固醇从组织细胞中泵出到HDL微粒上。ABCA1基因表达不足或有突变均会表现为HDL-C浓度降低。虽然HDL-C低一定是坏事,但并不是所有的HDL-C升高都是好亊,某些胆固醇反转运通道上的基因缺陷会造成HDL-C显著升高,同时伴随心血管病风险增高。例如SCARB1基因变异,会造成HDL-C不能通过SCARB1进入肝细胞被清除,表观上HDL-C浓度显著升高,但实质上胆固醇清除受阻,因此患者表现为HDL-C高但伴随严重动脉粥样硬化。血液中HDL-C浓度小于40mg/dL或大于70mg/dL都要怀疑胆固醇反转运通道有问题,这里只有基因检测才能真正区分好坏。
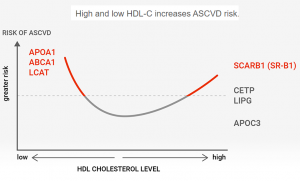
图5. HDL-C浓度与心血管病风险成U型曲线。HDL-C浓度太高和太低都会增加心血管病风险,由APOA1,ABCA1基因变异造成的HDL-C 降低以及由SCARB1造成的HDL-C升高均显著增加心血管病风险。
脂蛋白a - Lp(a)
第三个血液指标Lp(a),称为Lp little a,是一种LDL微粒的变体。Lp(a)浓度是一个终身稳定的指标,基本上完全由遗传因素决定,不受年龄性别饮食结构和生活习惯调节。血液浓度高于50mg/dL被临床定义为Lp(a)升高。Lp(a)是独立于LDL-C的另一个心血管疾病风险因子,在LDL-C等同条件下,Lp(a)高还会外加大约二倍的心血管病风险。Lp(a)完全由肝脏合成,每一个Lp(a)微粒由一个脂蛋白a肽链与一个LDL微粒通过apoB上的二硫键结合在一起,所以Lp(a)看起来很像多了一条脂蛋白a尾巴的LDL。 Lp(a)是一种灵长类(或人类)特有的脂蛋白微粒,编码脂蛋白a的基因LPA很晚才在进化树上出现,只有灵长类和少数几种动物才有LPA基因。Lp(a)的生理功能还不完全清楚,可能与促进凝血和修补血管壁破损有关。美国目前才刚刚开始给少数高风险人群检查Lp(a)水平,主要在心血管病专科。当医生发现某些心肌梗塞患者胆固醇水平并不高,但动脉粥样硬化严重,有经验的医生就会怀疑Lp(a)水平高了。决定Lp(a)水平高低的是LPA基因的长短,LPA基因越短,也称为LPA短型变异(short-isoform), 血液中Lp(a)水平就越高,反之亦然。人群中携带短型LPA的人数比较大,在非洲人中约30%,白人中大约有20%,亚洲人中约5-7%,所以短型LPA被认为是影响心血管疾病风险的最常见遗传因素。现在还没有任何上市的药物能够降低Lp(a)水平,饮食和锻练也都不能改变Lp(a)水平。LPA基因还有很长的故事要讲,将在第四章中详述。
除了上面讲到的家族性高胆固醇血症基因外,APOE,ABCG5/ABCG8等基因的突变也会造成类似高胆固醇血症的症状,并且心血管病风险严重升高。其中APOE基因失活突变导致三型高血脂,临床表现为总胆固醇升高和甘油三脂严重升高,但LDL-C并不高。APOE参与转运食品中吸收的胆固醇,有APOE基因缺陷的人不能吃太多高胆固醇食品。ABCG5/ABCG8基因参与肠道选择性吸收胆固醇并将植物类胆固醇排出体外,有这些基因突变的人会患谷固醇血症(sitisterolemia),需要避免吃太多的植物油和坚果。
另外,与血管舒张,氧化自由基清除,内皮细胞功能,高甘油三酯,肥胖,二型糖尿病等相关基因都可能影响心血管病风险。
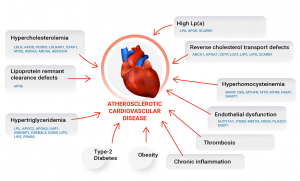
图6. 与动脉粥样硬化心血管疾病相关的生物通道和风险基因。
命运之争
心脑血管疾病看似发病位置在心脏和大脑,问题却主要出在肝脏,这是因为肝脏负责身中胆固醇供运链的调度和管理,一旦胆固醇管理出了问,血液中的胆固醇浓度就会升高,动脉粥样化的进程就会加快,最终导致心肌梗塞或各种缺血性心脑血管疾病疾病。
LDLR, APOB和PCSK9基因突变会导致家族性高胆固醇血症,这些基因的功能都围绕着肝脏对胆固醇的运送和回收。有这些基因突变的人如果没有及时诊断并寻求降胆固醇治疗,心血管疾病风险会是普通人的10-20倍。然而,有临床跟踪实验显示,如果基因突变携带者在青少年时期就被诊断,并且釆取了降胆固醇药物和饮食治疗,心血管病风险可以大为下降,心血管病出现的时间会比没有被治疗的人晚10-15年。大约1/100 - 1/200的人可能携带这类致病突变。
APOE基因突变会造成三型高血脂症,这些人发生早发心血管事件是普通人的5-10倍。改变饮食可以非常有效的让类人的降胆固醇降下来,但是現在流行的生酮饮食虽然减肥很有效但是也会让携带APOE基因突变的人胆固醇严重升高,心血管病风险大增。人群中少于1%人携带三型高血脂症的突变。
LPA基因短型变异是涉及人数最多的心血管病遗传风险,欧美人群中约有20%,中国人中少一些,大概有5-7%有这种变异。LPA短型变异与血液中Lp(a)升高有关,是一个独立的风险因子,可以在其他已有的风险因素(例如高胆固醇)的基础上再增加平均两倍的风险。现在还没有好的药物来降低Lp(a),饮食和锻练也都无法降低Lp(a)。不过现在己经有多家制药公司正在开RNAi降Lp(a)药物,期待不久的将来会有针对这个最常见的心血管病遗传风险的有效药物。
另外,与胆固醇反转运相关的基因APOA1,ABCA1,CETP,LCAT和SCARB1可以增加或减缓动脉粥样硬化,这些基因的表达有的可以被豆腐里的植物雌激素调节,有的可以被绿叶青菜红萝里的维生素A调节,有的可以被是否喝酒调节,有的可以被蛋黄里的卵磷脂调节,总之饮食营养如果应用正确,会对动脉粥样硬化的进程和心血管病风险有很大改变。
我们每个人会或多或少携带有各种程度不同的风险变异,这些风险变异的组合,就构成了不同程度的中间风险。有的人基因组合差一些,再加上生活习惯不好,出现心血管疾病症状的时间就早一些,有些人特别幸运,有最好的基因组和,再加上良好的生活习惯,活到100岁心脑血管还能正常工作。对大多数人来说,如果幸免不死于癌症,就或早或晚都逃不脱心脑血管疾病,那些特别长寿的人,都是逃过了癌症又逃过了心脑血管疾病的人。减缓动脉粥样硬化的进程,是长寿健康的必经之路。
虽然我们不能改变自己的基因,那是 “命” ,但是可以通过对致病机理的深入认识,为自己的健康谋求最佳出路,追求最好的 “运” 。在医学生物发达的今天,我们有机会以知识为武器,改变命运。
且听下回分解:
从基因的角度解析心血管疾病风险
(一)从肝脏到心脏
(二)细说胆固醇
(三)没人能逃避的动脉粥样硬化
(四)遗传组合
(五)精准医学与营养学
参考文献:
1. www.cdc.gov/genomics/implementation
2. Khera AV, Won H, Peloso GM, et al. Diagnostic Yield and Clinical Utility of Sequencing Familial Hypercholesterolemia Genes in Patients With Severe Hypercholesterolemia. J Am Coll Cardiol. 2016 Jun 7;67(22):2578-89. PMID: 27050191.
3. Stem AC, Knowles JW, Gidding SS et al. Clinical Genetic Testing for Familial Hypercholesterolemia: JACC Scientific Expert Panel. J Am Coll Cardio 2018 Aug 7;72(6):662-680. PMID: 30071997
4. Nordestgaard BG and Benn M. Genetic testing for familial hypercholesterolaemia is essential in individuals with high LDL cholesterol: who does it in the world? Eur Heart J. 2017 May 21;38(20):1580-1583. PMID: 28419271.
5. Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J. 2013 Dec;34(45):3478-90a.
6. Freiberg JJ, Tybjaerg-Hansen A, Jensen JS, et al. Nonfasting triglycerides and risk of ischemic stroke in the general population. JAMA. 2008 Nov 12;300(18):2142-52. PMID: 19001625.
7. Torvik K, Narverud I, Ottestad I, Svilaas A et al. Dietary counseling is associated with an improved lipid profile in children with familial hypercholesterolemia. Atherosclerosis. 2016 Jul 22;252:21-27. PMID: 27494447.
8. Bowe B, Xie Y, Xian H, Balasubramanian S, et al. High Density Lipoprotein Cholesterol and the Risk of All-Cause Mortality among U.S. Veterans. Clin J Am Soc Nephrol. 2016 Oct 7;11(10):1784-1793. PMID: 27515591.
9. Madsen CM, Anette Varbo A, Nordestgaard BG. Extreme high high-density lipoprotein cholesterol is paradoxically associated with high mortality in men and women: two prospective cohort studies. Eur Heart J. 2017 Aug 21;38(32):2478-2486. PMID: 28419274.
10. Zanoni P, Sumeet A Khetarpal SA, Daniel B Larach DB et al. Rare variant in scavenger receptor BI raises HDL cholesterol and increases risk of coronary heart disease. Science. 2016 Mar 11;351(6278):1166-71. PMID: 26965621.
11. Tietjen I, Hovingh GK, Singaraja R, et al. Increased risk of coronary artery disease in Caucasians with extremely low HDL cholesterol due to mutations in ABCA1, APOA1, and LCAT. Biochim Biophys Acta. 2012 Mar;1821(3):416-24. PMID: 21875686.
12. Frikke-Schmidt R, Nordestgaard BG, Stene MC, et al. Association of loss-of-function mutations in the ABCA1 gene with high-density lipoprotein cholesterol levels and risk of ischemic heart disease. JAMA. 2008 Jun 4;299(21):2524-32.
13. Schmidt K, Noureen A, Kronenberg F, Utermann G. Structure, function, and genetics of lipoprotein (a). J Lipid Res. 2016;57(8):1339-59.
14. Chasman DI, Dov Shiffman D, Zee RYL, et al. Polymorphism in the apolipoprotein(a) gene, plasma lipoprotein(a), cardiovascular disease, and low-dose aspirin therapy. Atherosclerosis. 2009 Apr;203(2):371-6. PMID: 18775538.
15. Kamstrup PR, Tybjærg-Hansen A, Nordestgaard BG. Elevated lipoprotein(a) and risk of aortic valve stenosis in the general population. J Am Coll Cardiol. 2014 Feb 11;63(5):470-7. PMID: 24161338.
16. Emdin CA, Khera AV, Natarajan P, et al. Phenotypic Characterization of Genetically Lowered Human Lipoprotein(a) Levels. J Am Coll Cardiol. 2016;68(25):2761-2772. PMID: 28007139
17. Paquette M, Bernard S, Thanassoulis G, Baass A. LPA genotype is associated with premature cardiovascular disease in familial hypercholesterolemia. J Clin Lipidol. 2019 Apr 23. pii: S1933-2874(19)30082-0. PMID: 31103339.
18. Scipione CA, McAiney JT, Simard DJ, et al. Characterization of the I4399M variant of apolipoprotein(a): implications for altered prothrombotic properties of lipoprotein(a). J Thromb Haemost. 2017 Sep;15(9):1834-1844.
19. Chasman DI, Shiffman D, Zee RY, et al. Polymorphism in the apolipoprotein(a) gene, plasma lipoprotein(a), cardiovascular disease, and low-dose aspirin therapy. Atherosclerosis. 2009 Apr;203(2):371-6. PMID: 18775538. (aspirin reduce CVD event about two fold but almost not effect to non-carrier).
20. Yang X, Sethi A, Yanek LR, et al. SCARB1 Gene Variants Are Associated With the Phenotype of Combined High High-Density Lipoprotein Cholesterol and High Lipoprotein (a). Circ Cardiovasc Genet. 2016 Oct;9(5):408-418. PMID: 27651445.
★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源