从基因的角度解析心血管疾病风险(二)细说胆固醇
By 沈骊 GB HealthWatch

第二章:细说胆固醇
毫无疑问高胆固醇是心血管疾病的罪魁祸首,连我们寿命的长短也很大程度取决于我们血液中胆固醇的高低。大家可能恨透了胆固醇,很多健康食品专门标识 “不含胆固醇” ,营养专家也经常告诫大家不要吃太多猪肝,蛋黄,奶酪等,因为这些食品胆固醇含量最高。其实胆固醇本身并不是坏人,相反,是我们身体中很重要的生物分子。身体中胆固醇含量最高的器官分别是大脑,肝脏,肾上腺素,性腺和皮肤,这些器官都需要大量的胆固醇供运才能正常运作,可见没有胆固醇人是活不了的。
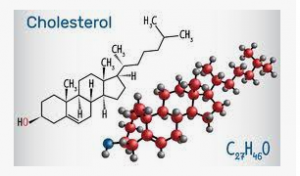
图1. 胆固醇分子的结构
细胞膜的” 钢筋“,思想的”钢筋“
胆固醇是细胞膜的重要组成成份,它和磷脂一起组成双层磷脂细胞膜结构。细胞膜中胆固醇与磷脂的比例,决定细胞膜的流动性;胆固醇比例越高,细胞膜流动性就越低,越能保持坚挺的细胞形状;相反胆固醇比例越低,细胞膜的流动性越高,细胞的形状就只能是圆球形。胆固醇分子的结构僵硬死板特别适合在细胞膜中起支撑和固定作用。所有动物细胞都依赖胆固醇分子维持细胞膜的強度和形状。微生物和植物细胞不含胆固醇,所以必须依赖细胞壁外壳维持细胞的型状。这也是为什么所有动物食品都含胆固醇而所有植物食品都不含胆固醇。在细胞膜上,胆固醇有点像钢筋混泥土里的钢筋,由胆固醇组成的脂肪与细胞内的“骨架”蛋白一起支撑起动物细胞的各种形状。如果没有胆固醇,动物细胞和器官都只能是圆乎乎的一团。胆固醇相对磷脂的比例越高,细胞膜就越硬扎有型。比如红血球长得像甜甜圈,为了支撑起甜甜圈的形状,红血球细胞膜中胆固醇含量大约是圆型细胞的三倍。胆固醇对磷脂比例最高的细胞膜是神经细胞膜,正是因为大量的胆固醇“钢筋“在神经细胞膜中才能支撑起神经网络层层叠叠的有序连线,才可能形成动物的大脑,也因此才可能产生人类的思想。可见没胆固醇的微生物和植物都不可能长出大脑和思想来。大脑是我们身体中胆固醇含量最高的器官。因为胆固醇对大脑实在是太重要了,以致于大脑根本不放心把胆固醇供运链交给饮食和肝脏掌管,而要全权控制大脑中胆固醇的自主合成。饮食摄入以及肝脏合成的胆固醇都几乎不能进入大脑。在大脑中负责胆固醇运输的APOE基因E4变异是迄今为止发现的老年痴呆症风险相关性最高的变异;携带有一条E4变异症风险增加2-3倍,而携带二条E4变异,风险增加10-15倍。APOE基因与老年痴呆症的紧密关系从另一个角度佐证了胆固醇对大脑功能的重要性。
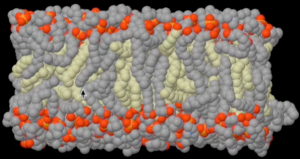
图2. 双层磷脂细胞膜模型中的胆固醇(黄色)
性欲的源泉,精力的源泉
胆固醇分子还是身体中各种甾体激素合成的起始底物。甾体激素包括我们大家熟悉的性激素,例如雄激素,雌激素和孕激素等。所有性激素都是以胆固醇为底物在性腺中合成的。当胆固醇供应不足时,就会缺乏性激素缺乏性欲,女人会停经生不出孩子来。这也是为什么中国三年自然灾害时,因为肉食严重缺乏,几乎没有小孩出生。除了性激素外,另一大类甾体激素统称肾上腺皮质激素,由肾上腺合成,包括糖皮质激素和盐皮质激素。糖皮质激素就是我们经常听说的紧张激素可的松,负责调节身体中碳水化合物代谢,日昼平衡,应激反应和免疫系统;盐皮质激素负责调节身体中钠钾平衡,维持血压。如果糖皮质激素和盐皮质激素不足,就会出现低血糖,低血压,混身乏力,没有精神。
除了性腺和肾上腺会消耗掉一小部分胆固醇外,胆固醇的两个最大去处,一个是皮肤,另一个是在肝脏用于合成胆汁。胆固醇是皮肤角质层的重要性组成部分,胆固醇不足皮肤会变得不保水粗糙容易感染生疮。胆固醇也是合成维生素D的前体,晒太阳时阳光里的紫外线会将皮肤上的胆固醇分子转化为维生素D。大部分胆固醇在肝脏被转化成胆汁分泌到肠道,帮助消化吸收脂肪和脂溶性微生素。可见如果身体中没有足够的胆固醇供应,我们就会体无完肤,不能生育,不能生存。
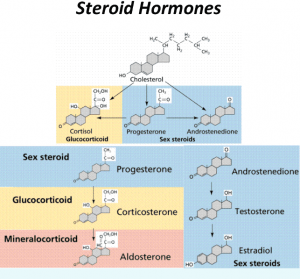
图3. 以胆固醇为底物合成各种甾体激素
胆固醇供运链
胆固醇对我们的身体如此重要,身体中必须有一整套系统来营运胆固醇供运链,以保障各器官对胆固醇的需求,其中肝脏是胆固醇供运链的总调度,负责生产,贮存,输出和回收胆固醇。身体中的胆固醇部分来自食物,部分来自肝脏的自主合成。大脑中的胆固醇是个例外,全部由大脑自主合成,食物和肝脏自主合成的胆固醇都几乎完全不能进入大脑。我们前面讲过微生物和植物都不含胆固醇,只有摄入动物食品才会获取胆固醇。胆固醇含量高的食品包括蛋黄,动物内脏以及皮肤。中国人喜欢的鸡翅鸭掌猪脑花等小吃都是高胆固醇食品,另外海鲜里的螃蟹大虾贝类也是高胆固醇食物。当从食物中摄入的胆固醇量不足时,肝脏就会启动自主合成生产线,以补足空缺;反之当食物中摄入的胆固醇量充足,肝脏就会降低自主合成产量,以维持供需平衡。在肝细胞中,这条生产线的“开“与“关”受肝细胞内部的胆固醇感应器调节。当肝细胞内部的胆固醇量降低到一定水平,这条生产线就会启动;相反,如果从食品中摄入的胆固醇量已经足够,肝细胞中的感应器会觉查到,相应的就会将自主合成生产线关闭掉。肝脏以乙酰辅酶A(acetyl-CoA)为底物合成胆固醇,乙酰辅酶A的最佳来源是通过氧化分解脂肪酸,这就是为什么吃太多高脂肪食品会造成胆固醇升高的原因。
肝脏就像身体中的后勤部,负责采买或自主生产身体中所需的胆固醇和其他营养物质,然后把这些营养物质搭配包装成脂蛋白微粒输出到血液循环中。这些装载着营养物质的脂蛋白微粒,可以比喻为营养包裹,随血液循环到达身体各目标器官,各器官按需截取营养包裹,那些没有被截取的包裹又随血液循环回到肝脏。肝脏然后根据回收到的包裹的数量和里面所装的内容的反馈调整下次输出包裹的数量和内容,以维持对身体的供需平衡。胆固醇供应链的工作方式有点像转盘寿司餐厅,厨房把一盘盘整理好的食物放到传送带上输出到餐厅里,食客根据自己的胃口从传送带上选取装有不同食品的盘子,没有被食客取走的盘子随传送带再回到厨房。厨房根据回来的盘子里所剩食品的反馈,就知道什么供应得太多了什么供应不足,从而调整下一批出盘的内容。肝脏就像这个比喻里的厨房,身体各器官就像餐厅里的食客各取所需,脂蛋白微粒就如装载着不同食品的盘子,而血液循环就像运送盘子的传送带。事实上在肝脏,胆固醇,脂溶性维生素,磷脂和甘油三醇等油脂类营养物质会打包在一起形成极低密度脂蛋白微粒(VLDL),然后分泌进入血液中。VLDL随血液循环去到外周各组织器官,其所运载的甘油三脂和磷脂首先被肌肉和脂肪细胞收割,随着甘油三酯被不断收割,VLDL微粒缩小成为IDL,最终失去大部份甘油三脂后变成主要含胆固醇的低密度脂蛋白微粒(LDL)。LDL微粒上的胆固醇称为低密度胆固醇,即LDL-C。LDL-C就是我们常说的“坏”胆固醇,同时也是肝脏向目标组织供运胆固醇的主要形式。
身体中所有需要胆固醇的细胞都会表达LDL受体,通过受体将载有胆固醇的LDL微粒转运进入细胞,从而获取胆固醇。LDLR是最重要的一种LDL受体,另外还有近10种类似的受体,称为LRP家族基因。LDLR表达量最高的细胞分别是雄性的睾丸,雌性的卵巢,肾上腺和肝细胞。性腺和肾上腺细胞很少自己生产胆固醇,主要依赖它们细胞膜上的LDLR受体截获血液循环中被LDL微粒运载的胆固醇,并用这些胆固醇作为底物合成性激素和肾上腺皮质激素。与其他组织不一样,肝细胞膜上的LDLR主要负责回收没有被外周组织截走的多余LDL微粒。这些被肝脏回收的LDL-C要么被再加工包装成VLDL再次进入血液循环,要么被肝脏转化成胆酸后通过分泌胆汁的形式进入肠道最终从粪便排出。
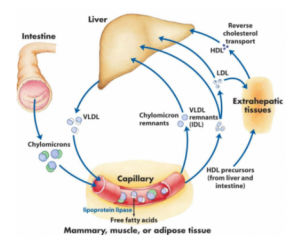
图4. 胆固醇供应链上的各组织器官
从胆固醇的供运链可以看到,肝脏是胆固醇的供应协调中心。身体中的胆固醇部分来自食品,部份由肝脏自主合成,因为从食品中摄入胆固醇后实际上会抑制肝脏合成,最终结果对血液中的胆固醇浓度影响很小,相反摄入大量高脂肪食品特别是高饱和脂肪酸食品确实会使血液中LDL-C增高20-30%,原因是燃烧脂肪酸产生的乙酰辅酶A可以被肝脏直接用来合成胆固醇。如果胆固醇浓度极度升高,原因一般不是因为吃高胆固醇食品,多半是因为肝脏回收胆固醇的环节出了问题,最常见的是有基因突变发生在家族性高胆固醇血症相关基因上,包括LDLR,APOB,PCSK9基因等。这些基因突变会导致血液循环中过剩的胆固醇不能被肝脏回收,结果肝细胞内的胆固醇感应器没有收到来自血液的反馈,以为血液中胆固醇不足,因此不但没有关闭肝脏中胆固醇自主合成生产线,反而加大产量和输出更多的胆固醇。这里我们可以清晰的看到,心血管疾病发病的位置是心脏,而真正出问题的地方其实是肝脏。
胆固醇在血液中的运输方式
胆固醇分子是脂溶性分子,不溶于水,必须与其他油脂分子和脂蛋白结合在一起形成内核疏水外表亲水的脂蛋白微粒才能在血液中运输。无论食物来源还是肝脏合成的胆固醇都得依靠脂蛋白微粒运载。油脂分子包括甘油三脂,磷脂,胆固醇和脂溶性维生素等都必须被包裹成脂蛋白微粒的形式,才能在血液中运输。血液中的脂蛋白微粒是一些大小不同运载的油脂组成也不同的小球,它们随血液循环将油脂分子运送到有需求的组织器官。在血液循环中主要有五种脂蛋白微粒负责上述油脂分子的运输,按大小排例它们分别是乳糜微粒(chylmicrome), 非常低密度脂蛋白微粒(VLDL), 中密度脂蛋白微粒(IDL),低密度脂蛋白微粒(LDL)和高密度脂蛋白微粒(HDL)。这个次序也反映这些脂蛋白微粒的密度从低到高。所有五种脂蛋白微粒都含有甘油三酯,磷脂,胆固醇和脂蛋白,只是每一种油脂的比例不同,其中乳糜微粒来自肠道,核心脂蛋白是apoB48,主要的油脂成份是甘油三酯;VLDL, IDL和LDL都来自肝脏,核心脂蛋白是apoB100,油脂成份VLDL甘油三酯最多,LDL胆固醇最多,IDL在这两者中间;HDL的核心脂蛋白是apoA,由肝脏合成,然后apoA通过收集外周组织中的胆固醇形成HDL微粒,主要油脂成份是胆固醇。
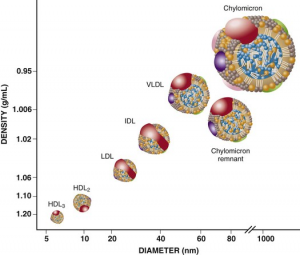
图5. 血液中的五种脂蛋白微粒
乳糜微粒
乳糜微粒是个头最大密度最低的脂蛋白微粒。乳糜微粒由肠细胞制造分泌并经淋巴管进入血液,其核心脂蛋白是apoB48,负责运载从食物中吸收的脂质类营养包括甘油三脂(85-92%),磷脂(6-12%),胆固醇(1-2%)和脂溶性维生素等。血液中乳糜微粒的量用餐后达到最高,很快微粒上的大量甘油三酯会被那些可以用脂肪为燃料和可以贮存脂肪的组织迅速”收割”走,这些组织包括心肌,骨胳肌,肝脏和脂肪组织。当乳糜微粒上的甘油三脂被“收割”走后,胆固醇仍留在的乳糜微粒残体上,残体个头较小,但是比LDL微粒大一些,所以有可能沉积到血管壁上。正常情况下残体上的apoE脂蛋白与肝细胞上的LDLR受体结合将残体内吞进入肝细胞,在这里apoE就像一把钥匙,负责打开LDLR这扇通往肝细胞的门。如果编码apoE脂蛋白的APOE基因有变异,造成开门的钥匙有缺陷,结果会造成乳糜微粒残体不能被肝脏及时吸收而滞留在血液中。携带某些APOE基因变异的人如果吃了高胆固醇食物,食物来源的胆固醇会浓缩在乳糜微粒残体上,如果不能被肝脏及时清除,滞留在血液中会参与动脉粥样硬化形成。所以这些人需要特别注意饮食中的胆固醇量。一小部分携带APOE基因变异的人会出现三型高血脂症,除了基因变异外三型高血脂症发病通常与肥胖和饮食中碳水化合物过高有关,临床表现为甘油三酯严重升高,总胆固醇升高,但是低密度胆固醇LDL-C正常或微弱升高。这些病人如果没有采取药物和饮食治疗,发生心血管疾病风险会比正常人高出5-10倍。饮食治疗对三型高血脂症非常有效。
极低中度和低密度脂蛋白微粒VLDL,IDL 和LDL
VLDL,IDL 和LDL都起源于肝脏,可以把这三种脂蛋白微粒看成肝脏向外周组织运送油脂类营养物的包裹。起源于肝脏的脂蛋白微短核心脂蛋白都是apoB100。VLDL首先由肝脏合成并分泌进入血液,在血液循环中逐渐失去甘油三酯后变成IDL,再从IDL变成LDL。我们前面讲过肝脏是身体的后勤部,负责釆购合成贮存人体所需的各种营养物质,然后根据身体的需求,将营养物质分类打包后释放到血液循环中。油脂类营养物质包括甘油三酯,磷脂,胆固醇和脂溶性维生素等首先在肝脏打包成极低密度脂蛋白微粒VLDL,刚释放到血液中的VLDL个头比较大比较轻,含有很大量的甘油三酯;随着VLDL微粒上的甘油三酯被肌肉和脂肪细胞 “收割“走后,个头逐渐变小,成为中等密度的脂蛋白微粒IDL(也被称为VLDL残体);IDL上的甘油三脂被进一步“收割“走后,最后成为个头很小主要含有胆固醇的低密度脂蛋白微粒LDL。每一个LDL微粒含有大约3000个胆固醇分子,LDL微粒上的胆固醇称为低密度胆固醇,即LDL-C。因为LDL微粒个头小胆固醇含量高,最容易进入血管壁内膜造成动脉粥样硬化,所以LDL-C被称为“坏”胆固醇。
LDL-C都是来源于肝脏。食品中摄入的胆固醇并不能直接变成LDL-C,但是饮食中如果摄入大量脂肪,特别是饱合脂肪酸,会促使肝脏自主合成更多胆固醇,所以高脂肪食品会直接造成LDL-C升高,而高胆固醇食品并不能。然而,会造成LDL-C严重升高的原因主要是肝脏回收血液中的LDL微粒的通道出了问题。LDL的核心脂蛋白是apoB100,apoB100上有一个富含正电荷胺基酸的区域负责与LDLR受体相结合,就像开门的钥匙一样打开LDLR这扇门而让LDL微粒进入细胞。无论“门” 坏了还是 “钥匙” 坏了其结果都是LDL微粒不能进入肝细胞而滞留在血液中,造成血液中LDL-C升高。家族性高胆固醇血症基因LDLR, APOB和PCSK9都是与肝脏回收血液中LDL微粒有关。这些基因上的某些突变会造成血液中LDL-C极度增高,携带这些突变的人如果没采用降胆固醇治疗,发生早发心血管病事件的几率可以是普通人群的10-20倍。
高密度脂蛋白微粒HDL
HDL是血液中个头最小密度最高的脂蛋白微粒。HDL主要负责身体中胆固醇的反转运,就是从外周细胞和组织中回收多余和破损的胆固醇,并运回肝脏消毁。与前面四种脂蛋白微粒不同,HDL的核心脂蛋白不是apoB,而是由APOA1基因编码的apoA。apoA首先由肝细胞合成并以裸体蛋白的形式分泌到血液中。裸体apoA脂蛋就是初始的HDL,它像 “费品回收小车 “,随血液循环到身体各器官组织中收集过剩或损坏了的胆固醇,并将这些回收来的胆固醇打包后运载回到肝脏,这个过程称为胆固醇反转运。越多的胆固醇被HDL收集并运送回到肝脏,沉积在血管壁上的胆固醇就越少,动脉粥样硬化的进程就越慢。因此,由HDL运载的胆固醇(HDL-C)被称为” 好” 胆固醇。其实并不是HDL上的胆固醇本身更好,只是被HDL收集到的胆固醇量越多,胆固醇反转运机制运行越好,血管壁越干净,对心血管健康越好。
“坏”与“好”胆固醇之分
我们每年体检都会查血脂,家庭医生会告诉你,LDL-C是 “坏”胆固醇,最好保持在130mg/dL以下,如果高于这个水平,医生多半会给你开他汀类降胆固醇药;而HDL-C是“好”胆固醇,最好高于50mg/dL,如果你的HDL-C太低,医生会告你要多吃蔬菜多锻练,锻炼可以升高好胆固醇。医生只是为了方便病人理解,用“好”和“坏”来形容不同脂蛋白微粒上的胆固醇。其实从血液检测的角度,并无好坏胆固醇之分,测量的都是一样的胆固醇分子。事实上,所谓“坏”胆固醇其实是由肝脏合成的新鲜胆固醇,分子本身更完好无损;而所谓“好”胆固醇其实是从外周组织和血管壁上回收到HDL微粒上来的胆固醇,有更多老旧破损的胆固醇分子。
胆固醇供运链与动脉粥样硬化
胆固醇是我们身体中不可或缺的营养物质,所有的细胞和组织都需要胆固醇。肝脏是胆固醇的釆购和供应中心,为了向身体各组织器官供应胆固醇,胆固醇和其他油脂类营养物质首先在肝脏被打包成脂蛋白微粒并释放到血液中;脂蛋白微粒是血液中运载胆固醇和其他油脂类营养的球型包裹,这些大小内容不同的包裹随血液循环去到各组织器官,把它们所载的营养物质送到目的地,其中LDL脂蛋白微粒主要运载胆固醇。在胆固醇供应链的另一端,所有需要获取胆固醇的组织都会在细胞表面表达LDLR,这些受体通过内吞机制将LDL微粒转运进入细胞。多余的没有被外周组织截取的LDL微粒会随血液循环回到肝脏,肝脏细胞表面LDLR会截取LDL微粒并转运进入肝脏。被肝脏回收的胆固酸会被再次利用或转化成胆酸后排出体外,被回收的胆固醇会给肝脏反馈,从而调整肝脏的合成和输出。如果某些与胆固醇回收相关的基因发生突变,例如家族性高胆固醇血症基因,肝脏不能正常回收胆固醇,血液中胆固醇就会升高,随之心脑血管病的风险也会增大。
胆固醇的主要危害是造成动脉粥样硬使血管狭窄堵塞。不幸的是只要胆固醇供运链通过血液循环搞运输,动脉粥样硬化就时时刻刻在进行中,无人能够逃脱。胆固醇是怎样参与动脉粥样硬化的?
且听下回分解
从基因的角度解析心血管疾病风险
(一)从肝脏到心脏
(二)细说胆固醇
(三)没人能逃避的动脉粥样硬化
(四)遗传组合
(五)精准医学与营养学
参考文献:
1. https://en.wikipedia.org/wiki/Cholesterol
2. https://en.wikipedia.org/wiki/Low-density_lipoprotein
3. https://en.wikipedia.org/wiki/De_novo_synthesis
4. Gidding SS, Allen NB. Cholesterol and Atherosclerotic Cardiovascular Disease: A Lifelong Problem. J Am Heart Assoc. 2019 Jun 4;8(11):e012924. PMID: 31137996.
5. Zampelas A , Magriplis E. New Insights into Cholesterol Functions: A Friend or an Enemy? Nutrients. 2019 Jul 18;11(7):1645. PMID: 31323871.
6. Zhang J and Liu Q. Cholesterol metabolism and homeostasis in the brain. Protein Cell. 2015 Apr; 6(4): 254–264. PMID: 25682154.
7. Laws SM et al. Expanding the association between the APOE gene and the risk of Alzheimer's disease: possible roles for APOE promoter polymorphisms and alterations in APOE transcription. J Neurochem. 2003 Mar;84(6):1215-36. PMID: 12614323.
8. Hu J, Zhang Z, Shen WJ, Azhar S. Cellular cholesterol delivery, intracellular processing and utilization for biosynthesis of steroid hormones. Nutr Metab (Lond). 2010 Jun 1;7:47. PMID: 20515451.
9. David E. Cohen. Balancing Cholesterol Synthesis and Absorption in the Gastrointestinal Tract. J Clin Lipidol. 2008 Apr; 2(2): S1–S3. PMID: 19343078.
10. Jones PJ, Pappu AS, Hatcher L, Li ZC, Illingworth DR, W E Connor WE. Dietary Cholesterol Feeding Suppresses Human Cholesterol Synthesis Measured by Deuterium Incorporation and Urinary Mevalonic Acid Levels. Arterioscler Thromb Vasc Biol. 1996 Oct;16(10):1222-8. PMID: 8857917.
11. Hu, F.B., et al., Dietary fat intake and the risk of coronary heart disease in women. N Engl J Med, 1997. 337(21): p. 1491-9. PMID: 9366580.
12. Hu, F.B., J.E. Manson, and W.C. Willett, Types of dietary fat and risk of coronary heart disease: a critical review. J Am Coll Nutr, 2001. 20(1): p. 5-19. PMID: 11293467.
13. Nordestgaard BG, Chapman MJ, Humphries SE, et al. Familial hypercholesterolaemia is underdiagnosed and undertreated in the general population: guidance for clinicians to prevent coronary heart disease: consensus statement of the European Atherosclerosis Society. Eur Heart J. 2013 Dec;34(45):3478-90a.
14. Freiberg JJ, Tybjaerg-Hansen A, Jensen JS, et al. Nonfasting triglycerides and risk of ischemic stroke in the general population. JAMA. 2008 Nov 12;300(18):2142-52. PMID: 19001625.
15. Torvik K, Narverud I, Ottestad I, Svilaas A et al. Dietary counseling is associated with an improved lipid profile in children with familial hypercholesterolemia. Atherosclerosis. 2016 Jul 22;252:21-27. PMID: 27494447.
★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源