哨卡抑制剂只是部分免疫疗法?
【新闻事件】:昨天我们讨论了《Science Translational Medicine》那篇认为所有抗癌药都有免疫成分的文章,今天《Science》又发表两篇文章指出哨卡抑制剂只是部分免疫疗法,肠道细菌制造的免疫背景是这些药物起效的一个关键因素。如果没有胃肠道拟杆菌或双岐杆菌,CTLA-4和PD-1抑制剂在黑色素瘤动物模型中活性大大折扣。引入这些细菌或含有这些细菌的粪便则可以恢复应答。
【药源解析】:CTLA-4和PD-1抑制剂虽然在某些癌症产生持久深度应答,但仍有大量病人无应答、多数肿瘤类型应答不如黑色素瘤。鉴于这些药物的高价格,如何预测应答人群是个重要问题以决定病人是否应该先使用较便宜的其它疗法。当然更重要的问题是如何把非应答人群转化为应答人群。今天这两篇文章虽然只是动物模型,但还是为扩大哨卡抑制剂的应答人群提出一个重要的研究方向。
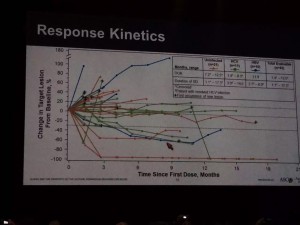
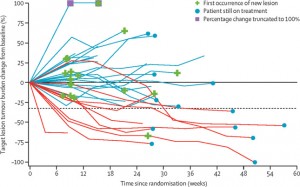
现在还不知道肠道细菌在临床中到底起多大作用。病人不是实验动物,生活环境高度差异化。即使同一病人胃肠细菌也会因为饮食、身体状况、使用抗生素情况有较大变化。所以如果这些细菌的存在是决定因素,那么对免疫疗法的应答和耐受将非常不规律。这种非线性应答似乎在临床试验中也有被观测到。比如Opdivo在晚期肝癌的一个实验中发现有病人在11个月无应答后突然肿瘤消失(下面左图中绿线)。另一个黑色素瘤实验有位病人前12周肿瘤一直在增大但后来开始出现部分应答(右图)。当然这些只是个例,但是这为没有应答的病人提供一线希望。
一个解决办法是确保每个病人胃肠道都有必要的细菌存在,当然首先要知道哪些细菌对那些药物治疗何种肿瘤是有益的,然后可以引入这些菌种。另一个办法是用有应答病人的粪便作为辅助治疗手段。这个所谓粪便疗法听起来有点另类,但其实是一个从50年代就有人用的治疗手段。前两年在治疗反复感染艰难梭菌的神奇疗效使这个古老的疗法再度回到大家视线中。如果这个疗法证明可以扩大免疫疗法适用人群,如何找到更方便的给药剂型将是一个有趣的科研课题。
对肿瘤免疫疗法研究的这些进展显示我们对生物体本身及其共生体系的理解还在原始阶段。如果不是免疫疗法的突出疗效,这些细节未必有人感兴趣。类似情况完全可能在其它药物使用中也同样存在,只是没人关注。这为我们的药物研发提出一个严肃问题。虽然大家常说新药研发nobody knows anything,但是多数人还是基本认同现在的研发体系的。如果象肿瘤细胞死亡诱发免疫反应、共生细菌免疫背景这些在寻找目标药物时根本没有考虑到的因素最后成为疗效的重要来源,我们应该如何对待基因剔除等确证靶点数据?如何使用与病人生活环境完全不同的实验动物(但基因背景、无菌环境、充足饮食等)数据?如果动物模型和病人差距如此之大(还没考虑物种差异、疾病与伪疾病的区别),新药进入临床前最应该在动物模型显示疗效还是显示可靠调控某一生物途径?默沙东研发总监Perlmutter说用我们现有的研发框架找到任何新药都是“bloody miracle” ,我们应该如何改变这种靠天吃饭的被动局面?
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源