Progenics制药公司报道抗体药物偶联物PSMA ADC的积极临床结果
作者:朱贵东
据全球商业电讯消息,美国Progenics制药公司2月14日在美国临床肿瘤学会(ASCO)、美国放射肿瘤学会(ASTRO)和泌尿肿瘤学会(SUO)共同主办的“2013年泌尿生殖系统癌症研讨会”上报道,该公司的抗体药物偶联物实验药PSMA ADC在一期临床实验中显示积极结果。
该一期临床是一个开放标签、多中心的实验,注册有52位转移性阉割难治性前列腺癌(mCRPC)患者,每三周静脉注射一次共四次九个剂量的PSMA ADC,完成一次疗程后,医生可以根据临床结果选择进一步的39周疗程。实验评价PSMA ADC的安全性和耐受性、药效、药物动力学、以及PSA和CTC与基线相比的变化。
实验发现绝大多数患者对PSMA ADC的耐受性良好,最大耐受剂量为2.5毫克/公斤。所有患者中1.8至2.8毫克/公斤剂量组的病人观察到明显疗效。中性粒细胞减少是在2.8毫克/公斤剂量组观察到的限制剂量的不良反应,其它常见副作用包括食欲减退和疲劳。
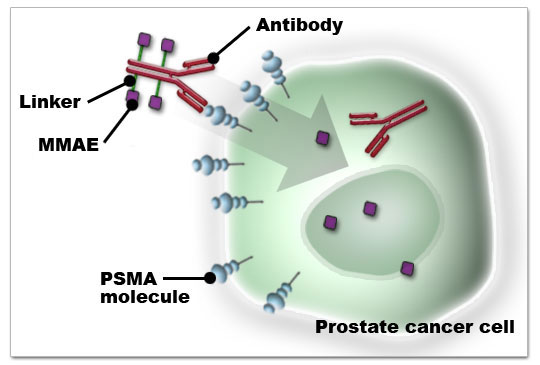
PSMA ADC是采用西雅图遗传公司的抗体药物偶联物技术制备的ADC药物,把靶向前列腺特异性膜抗原(PSMA)的单克隆抗体和MMAE连接起来。鉴于PSMA ADC一期临床的积极结果,Progenics在2012年九月开始一个开放标签、多中心的二期临床实验,预计注册75位转移性阉割难治性前列腺癌患者。观察终点包括疗效、PSA和CTC值变化、疼痛以及安全性。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源