美国FDA同意 Aeterna Zentaris制药公司的AEZS-108三期临床使用“特殊评估方案”
作者:朱贵东
据PR Newswire 12月28日报道,Aeterna Zentaris制药公司公布美国食品药品监督管理局(FDA)同意其候选药AEZS-108的三期临床使用“特殊评估方案”(special protocol assessment, SPA)。按照该SPA协议,FDA允许Aeterna Zentaris的新药申报(NDA)采用一个随机、多中心三期临床的设计方案、实验终点和数据统计,头对头比较AEZS-108和阿霉素作为二线药物治疗局部晚期,复发或转移性子宫内膜癌。
“特殊评估方案”是美国FDA接受不完整的三期临床实验设计、实验终点和数据统计作为新药申报(NDA)组成部分的声明。最终审批依然取决于候选药的疗效、不良反应以及获益/风险评估。
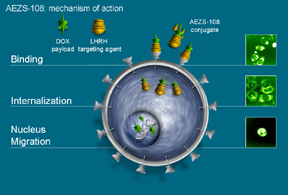
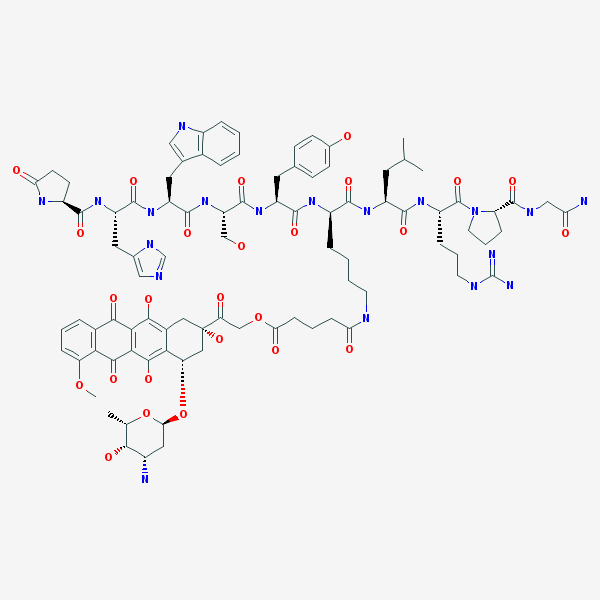
AEZS-108是一种新型靶向型抗肿瘤药物,把阿霉素和一个靶向促黄体激素释放激素(LHRH)受体的多肽连接(见下图化学结构),主要用于治疗对LHRH高表达的卵巢癌、子宫内膜癌、前列腺癌、乳腺癌和膀胱癌等。因为多肽和肿瘤细胞表面LHRH受体的亲和作用,导致AEZS-108在肿瘤细胞内的融合和富集作用,从而有效地提高了偶联物的靶向性。美国和欧共体药物监管部分已经授予AEZS-108的孤儿药地位。
11月18日,Aeterna Zentaris在柏林举行的第22届EORTC-NCI-AACR分子标靶和癌症治疗研讨会上公布AEZS-108的一个注册有43位晚期或复发子宫内膜癌患者的二期临床实验结果。患者每三周注射每平方米267毫克的AEZS-108,共六次。一级实验终点是患者的应答率,二级终点是不良反应、疾病进展的中位数和最终生存率。结果发现,有2位患者取得完全应答,占5.1%;10位病人达到部分应答,占25.6%;17为患者病情没有恶化,占43.6%。最终存活率和进展中位数分别为14.3和7个月,优于铂类抗癌药和紫杉醇类抗癌药的历史疗效。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源