FDA批准Gattex(teduglutide)用于治疗成人短肠综合征
作者:佚名
美国食品和药品监管局(FDA)今天批准Gattex(通用名:teduglutide)用于治疗需要静脉内肠道外营养的成人短肠综合征(SBS)。今年10月16日,FDA胃肠道药物咨询委员会(GIDAG)的12名成员投票,一致同意批准teduglutide上市,用于成人短肠综合征(SBS)的治疗。Gattex由NPS制药公司开发。
短肠综合征(short bowel syndrome,SBS)是由各种原因导致的小肠消化吸收面积大量减少而引起的一系列临床症候群。绝大多数SBS是后天获得的,仅有少数儿童是先天性的短肠。大多数SBS是因为各种腹部疾病手术治疗过程中广泛切除小肠所致,也可由小肠短路手术造成,极少数是由于大段肠管功能丧失引起。由于残余肠管过短,营养物质吸收消化障碍,可表现为腹泻、脂肪泻、体重下降,严重者甚至会危及生命。此类患者多不能正常饮食,有些通过积极恰当的肠康复治疗后可恢复经口饮食,但有些则需终生依赖肠外营养。
Gattex是胰高血糖素样肽-2(GLP-2)的类似物,前者是一个与肠道生长和功能相关的蛋白。Gattex是美国FDA自2004年以来再一次批准治疗SBS的药物,是除了现有繁琐的静脉内肠道外营养的给药方式之外,患者们的另一个选择。之前,FDA在2003和2004年批准了Zorbtive(somatrpin)和Nutrestore(glutamine)。在美国,预计约有10,000-15,000个成年人患有SBS。
Gattex临床试验显示出的安全隐患包括促进肿瘤生长的可能性、肠梗阻、胆囊炎及胰腺炎,但FDA及评审委员会认为此安全隐患是可以接受的。在所有使用Gattex的患者中,有3名的患者死于癌症:其中两例是肺癌,一例是转移性腺癌。然而,死于肺癌的患者恰好是重度吸烟者,而死于转移性腺癌的患者在之前就已诊断出患有霍奇金病,肝脏在治疗前就已经肿大并存在局灶性损伤。
来自FDA药品评价与研究中心的John Troiani博士在进行陈述时告诉评审专家小组,目前还不能完全排除Gattex与恶性肿瘤之间的相关性,我们建议提醒患者Gattex可能会加速恶性肿瘤的生长和增加患恶性肿瘤的风险。在此项研究中,所有死亡的患者都属于高危人群,因为他们要么吸烟要么在治疗前就有肝损伤。至于其他安全问题,本身在这个群体中便存在风险。评审专家小组认为制造商提议的风险评估和最小化策略适用于解决上述安全问题。
来自加拿大安大略省多伦多大学的Craig Earle博士认为,关于促进肿瘤生长方面的担忧可以通过仔细的监控和长期的随访来解决。他说:“关于这些患者患结肠癌的情况需要随访至少十年。而我不建议对小肠疾病进行常规筛查。来自宾夕法尼亚州费城托马斯杰弗逊大学的William K. Kelly同意上述说法,它认为teduglutide看起来似乎是安全的,但需要更的长时间去随访病人,至少需要七年或多达十年。我们也需要询问 teduglutide是否除处胃肠道之外的其他的作用位点。
Gattex的审批主要基于两个临床和两个延长实验结果,评价其疗效和安全性。实验中患者被随机分为给药组和安慰剂组。通过20至24周的治疗,观察降低百分之二十静脉内肠道营养的患者数。结果发现,给药组分别有百分之四十六和六十三的患者显示疗效,显著高于安慰剂组的百分之六和百分之三十。静脉内肠道营养的需用量也显著减少,给药组平均减少2.5和4.4升,高于安慰剂组的0.9和2.3升。
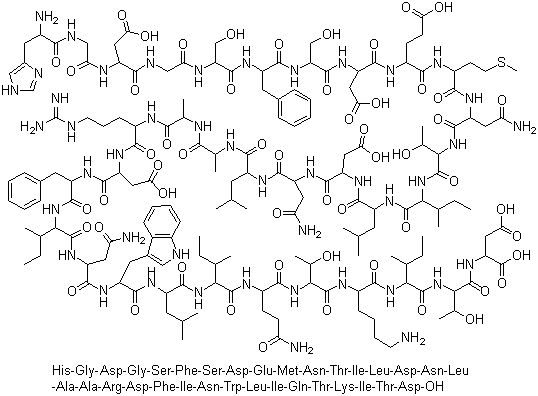
Gattex是一个含有33个氨基酸残基的多肽,其化学如下:
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★




















 微信号:美中药源
微信号:美中药源