要闻点评:美国FDA批准阿法替尼(afatinib)用于一线治疗转移性非小细胞肺癌
作者:吕顺
【新闻背景】2013年7月12日,美国食品和药物管理局(FDA)批准勃林格殷格翰制药公司(Boehringer Ingelheim Pharmaceuticals, Inc.)的Gilotrif片剂(阿法替尼,afatinib)用于一线治疗转移性的,且经FDA同时批准的匹配试剂盒测试,显示其表皮生长因子受体第19外显子缺失或第21外显子(L858R)替代突变的非小细胞肺癌。该TheraScreen EGFR RGQ PCR诊断试剂盒由Qiagen公司研发,用于检测患者肿瘤的表皮生长因子受体是否存在第19外显子缺失,或第21外显子(L858R)呈现替代突变。FDA批准阿法替尼的上市是基于一个国际、多中心、开放标签、且随机的三期临床实验结果。共有345 例来自欧洲、亚洲、美洲和澳大利亚的Ⅲ B/ Ⅳ 期非小细胞肺癌患者被纳入此项研究,这些病人之前未接受过晚期治疗,且表皮生长因子受体显示突变。受试者以2:1 的随机比例分别接受阿法替尼40 mg/qd(230 例),或顺铂/ 培美曲塞静脉给药(75mg/m2 +500mg/m2,21 d/ 周期,共6 个周期,115 例)。无进展生存期是实验的一级实验终点。
结果显示,两组患者的基线特征相当, Del19 突变占49%,L858R 突变占40%,其他突变类型占11%。在所有被随机的患者中,阿法替尼治疗组无进展生存(PFS)的中位数和顺铂/培美曲塞化疗组相比,从6.9个月延长至11.1个月(HR=0.58,P<0.001),具统计学显著。阿法替尼治疗组的客观缓解率(ORR)和对照组相比从19%增高至50.4%。但所有患者的最终生存期(OS)没有显著变化。在308 例常见突变类型(Del19/L858R)的患者中,无进展生存的中位数分别为13.6 和6.9 个月(HR= 0.47,P < 0.0001)。
阿法替尼治疗组最常见(发生率大于百分之二十)的不良反应包括腹泻、痤疮样皮疹/皮炎、口腔炎、甲沟炎、皮肤干燥、食欲下降和瘙痒。有29%的患者发生严重不良反应,其中包括腹泻(6.6%)、呕吐(4.8%)、呼吸困难、乏力以及低血钾(各占1.7%)。致命的不良反应有肺毒性/间质性肺疾病(ILD)(1.3%)、败血症(0.43%)和肺炎(0.43%)。
【药源解析】表皮生长因子受体(EGFR)激酶是受体酪氨酸激酶家族中的一员,在上皮源性的多种肿瘤上皮细胞内都有较高的表达,是肿瘤分子靶向治疗的重要靶点之一。EGFR抑制剂也是最先用于临床的抗肿瘤靶向药物之一。因为具有较高的靶向性,EGFR抑制剂类药物通常没有化疗药物常见的诸如骨髓抑制、脱发、肾功能损害等毒副作用。但随着时间的推移,使用这类药物最终会导致获得性耐药,也就是说多周期的用药将不再显示显著疗效。
阿法替尼(曾用名:BIBW2992)是一种新一代的选择性、口服酪氨酸激酶抑制剂(TKI),阿法替尼能不可逆地抑制ErbB 家族中的表皮生长因子受体(EGFR)和人类表皮生长因子受体2(HER2)。临床研究证实,阿法替尼能够克服一代络氨酸激酶抑制剂类药物治疗的获得性耐药,对包括厄洛替尼或吉非替尼等表现耐药的患者也显示明显疗效。
阿法替尼的上述临床研究是导致美国FDA批准该药上市的关键性临床实验,也是在EGFR突变阳性的肺癌患者进行的,首个将最佳化疗方案顺铂/ 培美曲塞方案作为对照治疗的规模最大的全球性、前瞻性临床试验。与接受顺铂/ 培美曲塞治疗患者相比,接受阿法替尼治疗患者的PFS获得显著延长,而且在次要研究终点方面也获得了显著改善。在整体人群中,阿法替尼治疗相关的不良事件均可被控制,且具有较低的不良事件导致的停药率。这些积极临床结果都支持该药是有临床意义的一线治疗选择。
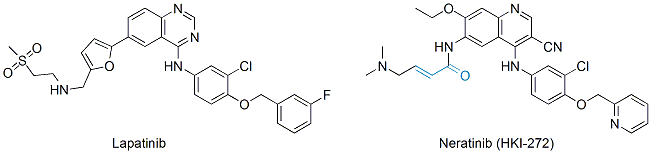
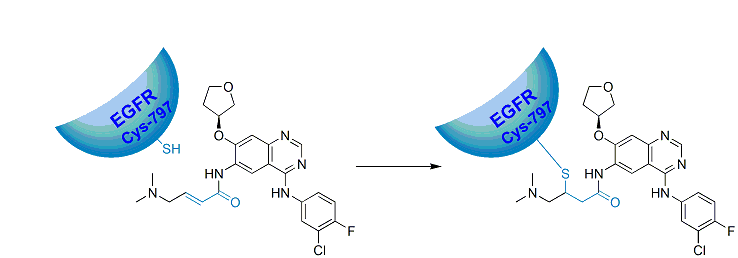
阿法替尼和GSK的拉帕替尼以及惠氏(现辉瑞)的neratinib一样,都是EGFR和HER2的双重抑制剂。也都因为同时抑制HER2,有望治疗包括乳腺癌在内的其它固体肿瘤。但和早在2007年上市的拉帕替尼不同,阿法替尼和neratinib都是不可逆的酪氨酸激酶抑制剂(见图),通过和EGFR中第797位半胱氨酸的巯基发生Michael加成反应,不可逆地抑制该络氨酸激酶的活性。事实证明,不可逆蛋白抑制剂不仅能表现良好的疗效,更重要的是同时也可以显示良好的,可控的毒理特征,为同类新药的开发提供新的佐证。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源