美国FDA批准Pharmacyclics和强生的“突破性药物” ibrutinib,用于治疗套细胞淋巴瘤
作者:吕顺
今天(2013年11月13日),美国FDA批准了Pharmacyclics和强生的Imbruvica(通用名:ibrutinib,依鲁替尼)上市,用于治疗一种罕见的侵袭性血癌——套细胞淋巴瘤(MCL)。
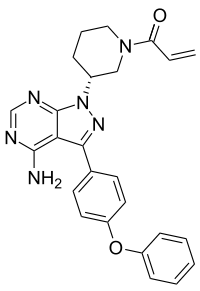
Ibrutinib(PCT-32765)是一种叫做布鲁顿酶(Bruton)的酪氨酸激酶的不可逆抑制剂(其化学结构上如下),能有效地阻止肿瘤从B细胞迁移到适应于肿瘤生长环境的淋巴组织。据不完全统计,ibrutinib已经做过或者正在进行23个临床实验,评价其单独或联合用药,治疗慢性淋巴细胞白血病(CLL)、复发/难治性套细胞淋巴瘤(MCL)、弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤和多发性骨髓瘤等。
MCL常见于中老年,是一种罕见但进展迅速的非霍奇金B细胞淋巴瘤(NHL)。在美国,其患者人数占据所有非霍奇金淋巴瘤病例的6%。在MCL被确诊的时候,通常已经扩散到淋巴结、骨髓和其它器官。Imbruvica用于之前至少已经接受过一种治疗的MCL患者。Imbruvica是获准用于治疗MCL的第三种药品。之前Velcade(Bortezomib for Injection,注射用硼替佐米。在我国注册名:万珂。2006年)和Revlimid的(Lenalidomide capsules,来那度胺胶囊。在我国注册名:瑞复美。2013年)已被批准用于治疗这种疾病。
Imbruvica的加速批准用于MCL治疗是基于一项有111名患者参与的研究,在研究中患者每天被配给560毫克的Imbruvica,直至他们的疾病出现恶化或无法忍受的副作用。结果发现,有17%的病人呈现完全应答,49%的患者部分应答,总应答率达66%,无进展生存期的中位数达17.5个月。接受Imbruvica的参与者报告的最常见副作用有血液中血小板水平下降(血小板减少症)、腹泻、抗感染白血细胞(中性粒细胞)减少 、贫血、乏力、肌肉骨骼疼痛、肿胀(水肿)、上呼吸道感染、恶心、紫癜、呼吸急促(呼吸困难)、便秘、皮疹、腹痛、呕吐、食欲下降。其它临床显著的副作用包括出血、感染、肾脏问题和其它类型癌症的发生。
今年2月,ibrutinib获美国FDA“突破性药物”称号。Imbruvica是FDA推出突破性新药新政以来获准的第二个享此待遇的药品。FDA于本月早些时候批准了罗氏(Roche)的Gazyva,用于治疗慢性淋巴细胞白血病(CLL),是首个获FDA突破疗法认定并获批的药物。
Imbruvica由总部位于加州的Pharmacyclics旗下Sunnyvale公司和扬森生物科技有限公司旗下的Raritan共同销售。目前,ibrutinib也正在等待FDA批准用于CLL。一些分析人士原以为,FDA会同时批准ibrutinib用于MCL和CLL。RBC资本市场分析师Michael Yee预计,ibrutinib的年度全球销售峰值将达到50亿美元。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源