Sofosbuvir—没有悬念的等待:美国FDA批准Sovaldi上市用于治疗丙型肝炎(HCV)
作者:吕顺
吉利德科学公司(Gilead Science)星期五(12月6日)宣布,美国FDA今天批准了其抗丙肝药物Sovaldi(通用名:Sofosbuvir)上市,与利巴韦林或利巴韦林/聚乙二醇干扰素(PEG-IFN)联用,治疗基因2、3型(+利巴韦林)或1、4、5、6型(+利巴韦林/聚乙二醇干扰素)丙型肝炎病毒(HCV)感染。至此,人类第一个全口服、无干扰素抗丙肝药物终于面世,标志着抗丙肝疗法进入一个新时代。今天无数丙肝患者期待着美国FDA的评审,但结果毫无悬念。
吉利德向美国FDA提供了6个积极的III期临床实验结果(NEUTRINO、FISSION、POSITRON、FUSION、VALENCE和PHOTON-1),其中两个结果支持了FDA授予其“突破性药物资格”。在本次FDA申报之前披露的临床结果里(Fission和Neutrino实验),吉利德声称每日口服一次400毫克Sovaldi联合利巴韦林和聚乙二醇化干扰素治疗12周后,对于那些常见的基因1、4、5、6型丙肝患者,有90%的病人治疗结束后达到了持久性病毒学应答(SVR12)。持久性病毒学应答的定义是治疗结束24周后仍检测不到病毒基因。而预期的只用利巴韦林与聚乙二醇化干扰素联合用药的SVR率为60%。对于那些较罕见基因类型的患者(Fission实验:选择感染2或3型丙肝病毒的病人)配以利巴韦林也达到67%的持久性病毒学应答。以上12周疗程的费用预定在每位84000美元,较罕见基因类型的患者需要两轮以上的治疗。Sofosbuvir临床试验中未发现严重不良反应,最常见的副作用包括疲劳、头痛、昏迷、失眠和贫血。分析家估计Sovaldi在2014年能为吉利德带来19亿美元的收入。
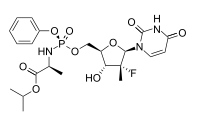
Sofosbuvir是NS5B聚合酶的口服核苷酸类抑制剂,由Pharmasset公司研制后被吉利德以110亿美元收购。Sofosbuvir是一个前药,在循环系统里释放靶向NS5B保守核苷酸结合袋的有效成分并终止链聚合反应。其化学结构如下:
目前,有近二十种的NS5B抑制剂处于处于不同阶段的临床实验中。其它走在前面的全口服抗丙肝新药包括雅培生命的三联剂和默克的MK-5172/MK-8742组合。这类全口服、无干扰素以及无利巴韦林的组合药物疗效更好,使用更方便,而且副作用远小于波西普韦或特拉普韦/干扰素/雷巴威林组合。是瓜分200亿美元抗丙肝市场的有生力量。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源