美国FDA批准又一个新抗生素Orbactiv(奥利万星),治疗成人的急性细菌性皮肤和皮肤结构感染(ABSSSIs)
作者:吕顺
【新闻事件】8月6日,美国FDA批准了又一个新抗生素Orbactiv(通用名:oritavancin,奥利万星)注射液,用于治疗成人患者的革兰氏阳性细菌(包括耐甲氧西林金黄色葡萄球菌,MRSA)引起的急性细菌性皮肤和皮肤结构感染(ABSSSIs)。FDA批准奥利万星注射液主要基于2项随机、双盲、多中心的积极临床实验结果(SOLO I和SOLO II实验),评价了单剂量奥利万星(1200毫克,静脉注射)治疗1987例ABSSSI患者的疗效和安全性,其中包括405例MRSA感染的一个患者亚组。结果表明,静脉注射一次1200毫克的奥利万星与连续7-10天每天注射2次万古霉素(vancomycin,1克或15毫克/公斤体重)在主要终点和次要终点均显示非劣性(non-inferiority)。
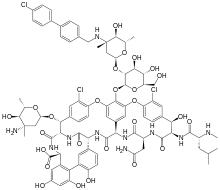
【药源解析】奥利万星是最近继FDA批准Sivextro和Dalvance之后,用于治疗成人急性细菌性皮肤和皮肤结构感染(ABSSSIs)的又一个新抗生素。奥利万星是一种新型第二代的半合成糖肽抗生素(glycopeptide antibiotic),其化学结构如下,和Dalvance以及目前金标万古霉素(vancomycin)都属于同一种类型。奥利万星是FDA批准用于ABSSSIs治疗的首个和唯一一种单剂量治疗方案的抗生素。也就是说,患者只需患者仅接受一次奥利万星输液,整个治疗方案便已结束。之前对细菌性皮肤和皮肤结构感染的治疗,包括Dalvance在内,患者往往需要多次静脉输注抗生素,而奥利万星的单剂量治疗方案显然具有给药便携性优势。
奥利万星也获得FDA的合格传染病产品(Qualified Infectious Disease Product,QIDP)认证。奥利万星的获批为完成美国传染病协会(IDSA)的10x20目标,即至2020年能开发10个新抗生素药物的目标有迈进了一步。单一剂量的奥利万星和常规给药的万古霉素疗效相似,可以减少患者伤口的20%,而且在头48-72小时内就能明显缓解患者的病情。适应于奥利万星治疗的急性细菌性皮肤和皮肤结构感染包括金黄色葡萄球菌(包括甲氧西林敏感和甲氧西林耐药菌株)、化脓性链球菌、无乳链球菌、停乳链球菌、咽峡炎链球菌群(包括S. anginosus、S. intermedius和S. constellatus)和粪肠球菌等革兰氏阳性细菌引起的感染。
奥利万星和Dalvance等其它抗生素的命运一样也曾几度易手。奥利万星最初由礼来公司研发(LY333328),在2001年被InterMune收购后又在2005年转让给Targanta Therapeutics。2008年,美国FDA拒绝直接批准奥利万星上市,要求Targanta补充申报材料。2009年,The Medicines Company收购了奥利万星并在今年2月再次向FDA申报上市。奥利万星虽然不是崭新机理,但和之前的抗生素相比有抗耐药和给药便携性区分,而且GAIN现行抗生素激励条款也明显增加了抗生素开放的盈利性。Medicines公司预计奥利万星每年最高可以带来4.5亿美元的销售。其它保守的估计其销售峰值在2亿美元左右。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源