肿瘤免疫疗法再下一城:安进BiTE单抗Blinatumomab(Blincyto)获得美国FDA批准上市
作者:吕顺
【新闻事件】今天下午,美国FDA批准了又一个革命性的肿瘤免疫疗法—双特异性T-细胞结合蛋白(BiTE)Blinatumomab(商品名:Blincyto)上市,治疗费氏染色体阴性的前体B细胞急性淋巴细胞白血病。Blincyto由生物制药巨头安进开发,是第一个上市的BiTE单链抗体。
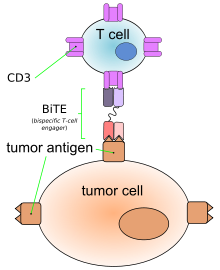
【药源解析】Blinatumomab最初由德国的Micromet公司研发,在2012年被安进以12亿美元的高价收购。如下图所示,Blinatumomab(AMG103)是利用DNA重组技术制备的一种双特异性的单链抗体BiTE,通过一条多肽链把靶向肿瘤细胞和T细胞表面抗原的两种单克隆抗体的可变区连接起来,这样和其它靶向肿瘤细胞抗原的单抗一样,Blinatumomab选择性地靶向B细胞表面抗原CD19,但是和其它抗癌单抗不同的是,Blinatumomab同时特异性地结合T细胞表面抗原CD3从而激活T细胞,活化的T细胞是杀伤肿瘤细胞的主要效应细胞。因为主要由两条单链抗体连接而成,BiTE的分子量较小(55-60kDa),容易渗透肿瘤组织。同时BiTE缺乏Fc段因而免疫源性较低。2014年7月,Blinatumomab获得美国FDA的“突破性药物”资格,治疗急性淋巴细胞白血病(ALL)。2014年10月,FDA又给予Blinatumomab“优先评审”(priority review)认定,处方费用户法案日期被定为2015年5月19日。
前体B细胞淋巴细胞白血病(Precursor B-cell lymphoblastic leukemia)是一种进展迅速的白血病,临床表现为骨髓产生太多B细胞淋巴母细胞。按照美国癌症研究院的数据,美国每年大约有6000人诊断为ALL,2014年的死亡人数大约为1440。在一个有185名费城染色体阴性的前体B细胞ALL患者参与的临床实验中,这些患者之前都经过治疗但都不再表现应答,经过Blincyto治疗(输注)四周或以上,有32%的患者在平均6.7个月内没有检测到肿瘤细胞的存在(完全缓解)。
药源刚刚讨论过,肿瘤免疫疗法的进展日新月异,Blinatumomab是美国FDA批准的首个双特异性T细胞结合蛋白,为肿瘤的免疫疗法又增加了一个上市品种。和免疫哨卡抑制剂Keytruda一样,Blinatumomab享受了FDA所有的审批优惠,包括优先评审、加速批准、突破性药物认定、和孤儿药。Blinatumomab比预期的批准日期提前了5个多月。因为是加速批准,美国FDA要求厂家继续进行Blinatumomab的临床研究,验证本品是否能提高这些复发性或难治性的,费城染色体阴性的前B细胞ALL患者的生存率。同时Blinatumomab伴有警告,提醒患者和医护人员一些试用者在该药早期经历低血压和呼吸困难(细胞因子释放综合征)、短期的思考困难、以及其它神经系统副作用。最常见不良事件包括发热、头痛、组织肿胀(外周水肿)、恶心、低钾、疲劳、便秘、腹泻和震颤等。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源