ADC到底是什么?(二十四)多弹头ADC

随着优质ADC靶点的枯竭,很多人开始在毒素上做文章。一个方向是多弹头ADC,一般是双弹头。当然每个技术出现都会有人把它推向想象的极限,比如最近有一篇文章将多达六种不同类型的药物负载到一个抗体上,药物-抗体比(DAR)最高可达30 [1]。今天聊一聊多弹头设计的骨感现实。
- 六个臭皮匠=卧龙+凤雏?
虽然常言说三个臭皮匠顶上一个诸葛亮,但臭皮匠也是有臭脾气的、六个臭皮匠不等于同时拥有卧龙凤雏。肿瘤确实是个多基因疾病,几乎没有一种肿瘤只用一种药就可以控制、即使暂时控制也难免复发。因此肿瘤治疗有很多治疗方案是多药联用,但即使临床使用的化疗药物组合叠加或协同作用也并不常见。2017年哈佛的科学家发现,FDA批准的组合疗法应答率高于单药主要是因为对多个药物分别有应答的患者在组合疗法打击下一次都应答了,这种情况组合给药和次序给药区别不大(见图一)[2]、但组合疗法增加毒性概率和患者经济负担。
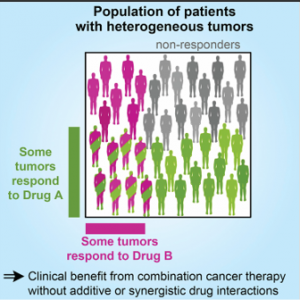
图一
一个实操的障碍是已知单方的可能组合数量远远多于临床上使用的组合疗法,即组合爆炸难题。所以必须有临床前高效筛选机制富集成功组合,否则不可能有足够患者参加临床试验来验证所有组合疗法。多化疗组合与单方比通常治疗窗口并无改进,只是少数有改进的组合保留下来了。诺华科学家根据小鼠PDX和预测模型估计只有<5%有单方活性的药物组合可能会产生叠加或协同效应[2,3],因为任何可能产生协同疗效的组合都可能产生协同毒性,而且几率更大、无论对单方还是复方来说毒性大于活性的化合物数量都远超有治疗窗口的药物(见图二,黑色是预测会帮倒忙的组合、彩色是至少与单方同效组合[2])。
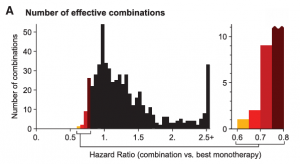
图二
- 临床前数据的转化难题
雪上加霜的是pick the winner难题对单方和组合疗法开发同样适用,这少数可能获益的组合有多少在临床能转化成患者收益还是未知数。尽管我们愿意相信药物是设计出来的、至少是临床前优化体系筛选出来的,但一个扎心的事实是多数首创药物是临床筛选出来的,比紫杉醇抑制微管蛋白效果更好的化合物多如牛毛、但进了临床通通只有毒性、没有活性。即使me-too药物都不一定能在临床前筛选,三个紫杉醇类药物结构变化很小、如同一人设计,显然设计者不相信筛选体系、不敢越雷池一步。有研究显示组合疗法临床研究有一半没有引用任何临床前研究,基本就是盲筛。多弹头ADC在人体的疗效和安全性都无法在动物实验可靠预测。
- ADC MTD由毒素决定
Colombo在2022年《Cancer Cell 》的那篇经典综述中比较令人信服地指出,在真正肿瘤患者ADC 的最大耐受剂量(MTD)往往与其所携带的小分子毒性药物MTD相当。我们以前分析过ADC虽然可能选择性在肿瘤释放毒素、但这只占总药量的1%不到,>99%毒素在正常组织释放、这些毒素最终要回到血液才能被人体清除。所以携带毒素的总量ADC比小分子药物并无太大区别,比如Trodelvy比伊利替康的血液SN38 AUC还高十几倍、较起真来谁是更魔法的子弹还不好说。如果单弹头ADC的MTD与毒素类似,没有理由怀疑多弹头ADC有什么不同。
- PK同步吗?
多弹头ADC因为毒素都在一个分子上理论上实现了毒素释放的“PK同步”,但几乎所有ADC 毒素在肿瘤之外组织释放并最终回到血液、与小分子组合静脉滴注对于外周毒性(ADC的主要毒性)不会有显著差别。ADC依赖非平衡药物分布、与小分子系统给药通过血液与各组织达到分布平衡的工作机制不同,不同毒素组织逃逸动、旁观者效应(过膜性)、肿瘤杀伤动力学的差异会严重影响肿瘤杀伤叠加作用。另外因为只有少量毒素在肿瘤和在靶脱组织释放,所以各个毒素在肿瘤比例的个体差异比血液循环的个体差异要大。这可能导致外周毒性稳定地与化疗组合类似,但肿瘤疗效和在靶毒性却个体或整体差异都很大。
- 高DAR 的开发挑战
高于DAR 8的ADC已被认为开发难度巨大,DAR20-30就更难了。负载越多,分子越疏水,越容易聚集,即便使用疏水性掩盖等技术也难以完全解决这一问题。高DAR引起的免疫原性也是问题,CMC复杂度也会几何级增长、每添加一种新毒素就意味着新增一系列杂质谱和质控点。
- 多靶点药物的教训
很多癌症治疗方案依赖联合用药,但将“联合用药”转化为“共轭用药”却成功率不高。组合疗法依赖灵活性,即药物剂量可调、可停、可错峰投用,而当六种药物被永久性地绑在一个抗体上后,剂量调节的空间就不存在了。多弹头ADC并不是第一次尝试多靶点共价化设计,多靶点小分子药(multiple ligands)几十年前就是一个热门领域,但尽管临床前看着不错但临床只有少数如bendamustine的成功案例。一旦一个成分的毒性限制了剂量,其他药物也随之被“绑架”,只能在亚治疗剂量下发挥作用。确实有些机理可以被很低剂量第二个组分曾敏,但这和开发FIC没有什么本质区别。
- Pipeline in a drug
有些药物如修美乐、K药适应症多,每个适应症开发成功几率高,所以被叫做pipeline in a drug,但把多个药物共价链接成一个药物难以复制这个理念。根据化疗的经验,次序使用不同毒素的ADC可能是更可控、更安全的策略。
小结
组合疗法开发的障碍也同样是多毒素ADC开发的障碍,可能的组合太多、但有叠加协同效应组合很少,临床前没有可靠的筛选系统。化疗的治疗窗口都很小,不是1也达不到2、没有多少出错空间,所以如果固定比例不能调节剂量和给药频率自缚手脚就更难找到获胜组合。次序使用ADC已经是临床实践,至少短期内这可能是更可靠、更安全的利用不同毒素的策略。
参考文献:
[1] Meng, Xun, et al. "Antibody-mediated co-delivery of programmable drug combinations." (2024).
[2] Palmer, Adam C., and Peter K. Sorger. "Combination cancer therapy can confer benefit via patient-to-patient variability without drug additivity or synergy." Cell 171.7 (2017): 1678-1691.
[3] Gao, Hui, et al. "High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response." Nature medicine 21.11 (2015): 1318-1325.
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★



















 微信号:美中药源
微信号:美中药源