
今天诺华宣布将以39亿美元、溢价44%(相对于9月末谣言传出时价格)收购法国生物技术公司Advanced Accelerator Applications (AAAP)。
Continue reading …
今天强生宣布将终止其IL6抗体、关节炎药物sirukumab的临床开发,并停止招募另一个重要在研药物、CD123抗体talacotuzumab(AML)的一个关键二/三期临床试验。
Continue reading …
今天礼来宣布其CDK4/6抑制剂abemaciclib(商品名Verzenio)在一个叫做Jupiter的三期临床试验中未能达到一级终点。这个试验招募453位晚期Kras变异非小细胞肺癌患者,比较一日两次不间断使用Verzenio与罗氏EGFR抑制剂特罗凯对OS的影响。
Continue reading …
今天美国生物技术公司CytomX与安进开始总额可达15亿美元的合作。在主要的EGFR双特异抗体项目CytomX将获4000万首付、2000万投资、和最高可达4.55亿的里程金。
Continue reading …
今天《JAMA Internal Medicine》发表一篇文章计算最近抗癌药的研发成本。这个分析统计了2006-2015这10年间的10个抗肿瘤新药的开发成本。
Continue reading …
今天法国生物技术公司Cellectis宣布其异体CAR-T药物UCART123在一个BPDCN一期临床试验中造成一名患者死亡。这是这个试验招募的第一个病人,死因是细胞因子风暴(CRS)和毛细血管渗透综合症(CLS)。
Continue reading …
本期的《自然药物发现》杂志发表一篇短文介绍现在合成致死靶点的系统筛选。随着RNAi技术的更加精准和CRISPR技术的出现,大规模体内、体外筛选单个基因剔除对肿瘤细胞生存影响成为可能。如果这种单基因剔除试验在两种细胞(一种有肿瘤常见突变、另一种无突变)进行,则可能找到合成致死配对基因。
Continue reading …
今天FDA批准了诺华的CAR-T药物Kymriah (通用名tisagenlecleucel,曾用名CTL019)用于25岁以下青少年难治或二次复发ALL。这个批准是根据一个63人参与的临床试验,在这个难治人群Kymriah三个月应答率为83%,一年应答率为79%。
Continue reading …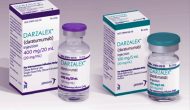
今天丹麦生物技术公司Genmab宣布CD38抗体Daratumumab(商品名DARZALEX)在一线多发性骨髓瘤(MM)与硼替佐米、美法仑、泼尼松(VMP)联用比单独使用VMP降低50%进展/死亡风险。
Continue reading …
今天FDA批准了辉瑞的CD22抗体inotuzumab 与烯二炔毒素ozogamicin 的抗体药物偶联药物(ADC)Besponsa(通用名inotuzumab ozogamicin),用于成人复发难治B细胞ALL。
Continue reading …
今天美国生物技术公司Exelixis向FDA递交了其MET/VEGF双抑制剂Cabometyx(通用名cabozantinib)的一线肾癌申请。这个申请是根据一个叫做CABOSUN的二期临床结果。
Continue reading …
今天施贵宝公布了其Opdivo/Yervoy组合作为一线疗法在晚期肾癌(RCC)病人与Sutent比较的三期临床CM214的顶层数据。O/Y组合的应答率为41.6%,Sutent为26.5%,达到这个一级终点。但是这个组合错过mPFS这个一级终点(11.6对8.4个月,但未达到统计显著)。
Continue reading …























 微信号:美中药源
微信号:美中药源