阿斯利康非小细胞肺癌新药Tagrisso(osimertinib)获得加速批准,创FDA审评记录?
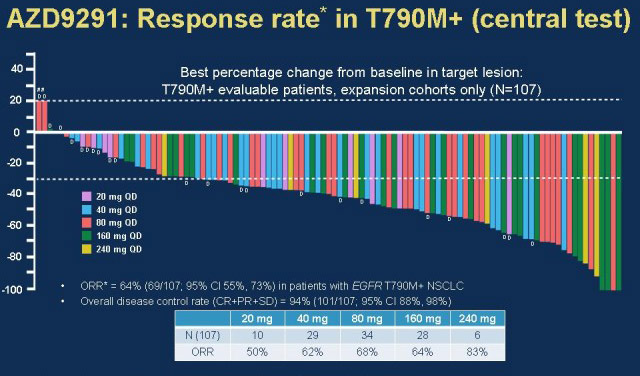
【新闻事件】:美国FDA今天通过加速批准通道批准了阿斯利康的osimertinib(商品名:Tagrisso)上市,治疗表皮生长因子受体(EGFR)T790M突变或对其它EGFR抑制剂耐药的晚期非小细胞肺癌患者。FDA同时还批准了第一个EGFR耐药突变伴随检验试剂盒(cobas EGFR Mutation Test v2)。在2个单臂、多中心、共有411名受试者参与的2期临床试验中,这些受试者要么经检测具有EGFR T790M突变,要么之前经过其它EGFR抑制剂治疗但依然有进展。在这两个试验中Tagrisso的客观应答率(ORR)分别为57%和61%。伴随治疗的最常见副作用有腹泻、皮肤干燥、皮疹、指甲红肿或感染等。Tagrisso的疗效和安全性需进一步在3期临床试验中得到证实才能获得FDA的完全批准。
【药源解析】:昨天药源刚刚讨论过,因为开发生物制剂(比如单克隆抗体)有诸多优势,传统小分子药物的开发越来越面临生存压力。那么作为当年制药工业主打产品的小分子药物应该何去何从呢?今天阿斯利康Tagrisso的开发过程则是小分子药物开发的一个完美实例。
按照现代生物学标准,传统意义的适应症实在是多种疾病的组合,靶向一个分子靶点的药物不大可能对所有病人都有效。肿瘤药物的开发尤其如此,每一种癌症都是多种疾病、多个疾病亚型的组合。靶向一个特定的分子靶点只有对非常确定的患者亚群表现疗效。比如辉瑞的Crizotinib只适用于ALK突变的非小细胞肺癌,而这类患者仅占患者总数的4-5%。罗氏的络氨酸抑制剂厄洛替尼和阿斯利康的吉非替尼也只对EGFR突变的非小细胞肺癌患者有效。所以现代小分子药物的开发已经越来越针对这些特定的患者亚群(个体化治疗)。
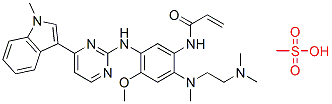
虽然一代EGFR抑制剂对EGFR突变的非小细胞肺癌患者非常有效,但几乎所有患者最终都会产生耐药性。其中大约50-60%患者的耐药是因为EGFR T790M突变引起。而Tagrisso就是针对具有EGFR T790M突变的患者亚群,满足这类未满足的市场需求。Tagrisso选择性高,对T790M/L858R突变和外显子19 缺失EGFR的IC50分别是11.4 nM和12.9 nM,而对野生型EGFR的抑制剂活性(IC50)是494 nM。Tagrisso一天一次口服,而且是不可逆的EGFR抑制剂(化学结构见下图)。
因为Tagrisso是EGFR的不可逆抑制剂,能和分子靶点形成共价键,所以理论上应答持续更久,产生耐药的机会相应减少。所以如果Tagrisso能最终获批作为EGFR突变非小细胞肺癌的一线用药,有望达到阿斯利康30亿美元销售峰值的乐观商业预期。Tagrisso获得了FDA的“突破性药物”和“罕见病药物(孤儿药)”认定以及“优先评审”的奖励,其开发立项和过程符合我们昨天讨论的“人群小/单价高/附加值高的小分子新药开发特点,成为现代小分子药物开发的又一个典范。
Tagrisso的开发时间很短,笔者能找到的最早临床试验在2013年9月注册,也就是说从临床开发至上市花费不到2.5年的时间,可能再创美国最快临床开发的记录。
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★

2 Responses to 阿斯利康非小细胞肺癌新药Tagrisso(osimertinib)获得加速批准,创FDA审评记录?
发表评论
要发表评论,您必须先登录。


















 微信号:美中药源
微信号:美中药源
Pingback: FDA抗癌药专家委员会12:1拒绝提前批准rociletinib | 美中药源
Pingback: 股市吸星大法:Clovis肺癌药物引发股票暴跌70% | 美中药源