FDA批准首个抗体生物类似药
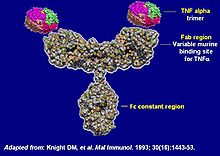
【新闻事件】:今天FDA批准了辉瑞和韩国生物技术公司Celltrion的生物类似药infliximab-dyyb(辉瑞商品名Inflectra ,Celltrion的商品名Remsima)。Infliximab-dyyb是强生重磅药物Remicade(英利昔单抗),FDA今天批准了infliximab-dyyb在所有Remicade适应症的使用。这是FDA继去年批准诺华旗下山多士的Zarxio(安进Neupogen的生物类似药)而批准的第二个生物类似药,但Zarxio是粒细胞集落刺激因子,技术难度低于单克隆抗体Remicade。今天这个批准标志着生物类似药全面进军美国市场。
【药源解析】:最近王守业博士写了一系列有关生物类似药的文章,有兴趣的读者可以看看这个非常全面的四部曲。过去20年制药工业的重磅药物从小分子向生物大分子转移,去年世界10大药物有7个是生物大分子,Remicade名列第三。所以专利过期后这些产品自然成为仿制药厂家追逐的目标。
但是生物类似药因为技术难度大、开发成本高、开发风险大等特点,一般价格上没有小分子仿制药优势大。欧洲多年的经验表明生物类似药一般比原研药物便宜20-30%,所以原研药还有很大的竞争力。另外原研厂家可以推出一些换代产品如Gazyva代替Rituxan,令仿制厂家处于被动局面。但是去年Celltrion的这个Remsima在挪威以70%折扣销售,这对原研药就是致命打击了。
美国现在也处于医疗开支重压之下。新产品如PD-1抗体疗效很好,支付部门没有理由拒绝高价。最容易开刀的就是和专利过期药无显著改进的所谓me-too药物和专利过期的生物药。当然美国的联邦法只能管辖生物类似药如何批准,具体使用各州有很大权利。现在一般看法是生物类似药争夺已经使用原研药的患者几率较小,但新患者可能会逐渐使用这些便宜的生物类似药。
Remicade是上一代重磅药物的重要代表,是个免疫抑制,用于多种自身免疫疾病。而下一代重磅药物最有可能是激活免疫系统的肿瘤免疫疗法,真是吃完被告吃原告。当然这些药物或延长了病人生命或给生活质量带来很大改进,投资者理应获得相应回报。美国生物类似药政策迟迟没有定论,上周发布的最新指南对仿制厂家十分有利。喜欢与否,美国市场已经全面向生物类似药开放。
推荐阅读:
聚焦生物类似药(1):何为生物类似药?
聚焦生物类似药(2):生物类似药 VS. 化学仿制药
聚焦生物类似药(3):火热背后的冷思考
聚焦生物类似药(4):技术门槛有多高?
图片来源网络
美中药源原创文章,转载注明出处并添加超链接,商业用途需经书面授权。★更多深度解析访问《美中药源》~
★ 请关注《美中药源》微信公众号 ★

3 Responses to FDA批准首个抗体生物类似药
发表评论
要发表评论,您必须先登录。


















 微信号:美中药源
微信号:美中药源
Pingback: Puma提交Neratinib上市申请 | 美中药源
Pingback: 再生元止痛药fasinumab二/三期临床显示疗效,NGF抗体依旧扑朔迷离 | 美中药源
Pingback: FDA批准首个蛋白相互作用抑制剂Venetoclax | 美中药源