今天《自然药物发现》杂志发表一篇阿斯列康和赛诺菲科学家合作撰写题为“指挥演化:新药发现下一次革命?”的文章。该文介绍了利用演化基本原理发现新型药物的现状和未来趋势,文章介绍不少现在产生生物活性化合物的新技术。虽然现在离高速突变、自然选择合成结构复杂小分子药物的理想状态还有不少技术空白需要填补,但这个领域也确实初具规模。
Continue reading …
今天奥地利生物技术公司Nabriva Therapeutics 宣布其新型抗生素lefamulin在一个社区获得性细菌性肺炎(CABP)的三期临床试验中与莫西沙星比显示非劣效。
Continue reading …
今天Sage Therapeutics宣布其超级难治癫痫(SRSE)药物brexanolone(别孕烯醇酮,又名SAGE-547)的STATUS三期临床没有达到试验终点。在这个140人参与的临床试验中,
Continue reading …
今天《JAMA Internal Medicine》发表一篇文章计算最近抗癌药的研发成本。这个分析统计了2006-2015这10年间的10个抗肿瘤新药的开发成本。
Continue reading …
今天法国生物技术公司Cellectis宣布其异体CAR-T药物UCART123在一个BPDCN一期临床试验中造成一名患者死亡。这是这个试验招募的第一个病人,死因是细胞因子风暴(CRS)和毛细血管渗透综合症(CLS)。
Continue reading …
本期的《自然药物发现》杂志发表一篇短文介绍现在合成致死靶点的系统筛选。随着RNAi技术的更加精准和CRISPR技术的出现,大规模体内、体外筛选单个基因剔除对肿瘤细胞生存影响成为可能。如果这种单基因剔除试验在两种细胞(一种有肿瘤常见突变、另一种无突变)进行,则可能找到合成致死配对基因。
Continue reading …
今天FDA批准了诺华的CAR-T药物Kymriah (通用名tisagenlecleucel,曾用名CTL019)用于25岁以下青少年难治或二次复发ALL。这个批准是根据一个63人参与的临床试验,在这个难治人群Kymriah三个月应答率为83%,一年应答率为79%。
Continue reading …
今天默沙东发表了其CETP抑制剂Anacetrapib的三期临床REVEAL试验结果。30,449名心脏病患者在他汀背景上使用4.1年ana显著降低由心血管死亡、心梗、冠状动脉再通组成的复合终点事件频率。
Continue reading …
今天诺和诺德宣布其GLP-1激动剂利拉鲁肽(商品名Victoza)获得FDA降低心血管疾病风险标签,这有别于礼来的SGLT2抑制剂Jardiance的降低心血管死亡风险的标签。
Continue reading …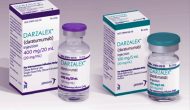
今天丹麦生物技术公司Genmab宣布CD38抗体Daratumumab(商品名DARZALEX)在一线多发性骨髓瘤(MM)与硼替佐米、美法仑、泼尼松(VMP)联用比单独使用VMP降低50%进展/死亡风险。
Continue reading …
今天FDA批准了Ironwood的复方痛风药物Duzallo。这是 Zurampic(通用名lesinurad)和别嘌呤醇的固定剂量组合。Duzallo是一日一次口服药物,有200毫克Zurampic加200或300毫克别嘌呤醇两个剂量。
Continue reading …
今天FDA批准了辉瑞的CD22抗体inotuzumab 与烯二炔毒素ozogamicin 的抗体药物偶联药物(ADC)Besponsa(通用名inotuzumab ozogamicin),用于成人复发难治B细胞ALL。
Continue reading …





















 微信号:美中药源
微信号:美中药源