今天Seattle Genetics宣布将以6.14亿美元收购邻居Cascadian Therapeutics。CASC原名Oncothyreon,肿瘤疫苗Stimuvax失败后更名,现在的核心资产是HER2抑制剂tucatinib。
Continue reading …
今天Puma Biotechnology宣布EMA的CHMP委员会对其EGFR/HER2双抑制剂Neratinib作为HER2阳性乳腺癌患者手术后维持疗法在欧洲的上市申请持否定态度,这意味着这个委员会在今年二月的投票将对Puma十分不利。
Continue reading …
2017年FDA共批准了42个新分子药物和2个CAR-T疗法,是历史上少见的丰收年。诸多高新生物技术完成漫长的转化过程开始进入市场,以Kymriah、Yescarta的上市为标志。基因疗法有望短期内上市治疗某些视网膜疾病,在血友病、SMA治疗的早期疗效也非常激动人心。RNAi在几度沉浮后终于显示上市潜力,而mRNA技术也开始进入临床。
Continue reading …
昨天默沙东宣布其PD-1抗体Keytruda在一个叫做Keynote-061的胃癌三期临床失败,作为二线用药未能比标准化疗相改进PD-L1阳性胃癌患者的总生存期和无进展生存期。
Continue reading …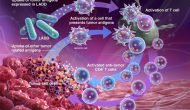
今天生物技术公司Aduro Biotech宣布将放弃其以李斯特细菌为载体的肿瘤疫苗CRX-207的临床开发,正在进行的间质瘤、卵巢癌、胃癌的试验都将停止。Aduro宣布将集中经历开发其STING激动剂和利用其李斯特细菌平台(LADD)开发肿瘤新抗原疫苗。
Continue reading …
今天生物技术企业家Michael Gilman创建的CAR-T企业Obsidian获得4950万美元A轮融资,Atlas Vc、武田、福泰以及中国的尚华参与投资。
Continue reading …
今天辉瑞和德国默克宣布其PD-L1抗体Avelumab (商品名Bavencio)在一个叫做JAVELIN Gastric 300的三期临床未能达到一级终点。这个国际多中心试验招募371位使用两种疗法复发的晚期胃癌患者,分别使用Bavencio和医生选择的化疗疗法。
Continue reading …
今天罗氏旗下基因泰克宣布其PD-L1抗体atezolizumab (商品名Tecentriq)在一个非鳞状非小细胞肺癌三期临床在标准疗法背景上显著改善PFS。这个叫做IMpower150的三期临床试验招募1202一线NSCLC患者,
Continue reading …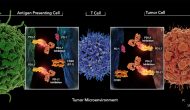
借着免疫疗法协会年会东风,Cancer Research Institute(CRI)统计了现在PD-1药物研发情况。除了已经上市的5个PD-1药物和正在临床三期研究的三个,现在临床、临床前还有近160个PD-1药物在开发中,其中9个已经进入二期临床。CRI统计现在有1502个PD-1药物临床,其中1105个是组合疗法试验。
Continue reading …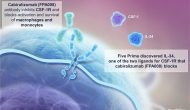
今天Five Prime公布了其CSF1R抗体cabiralizumab (FPA008)与Opdivo联用的部分一期临床结果。此组合在二线胰腺癌患者产生10%客观应答、6个月疾病控制率为13%。但43%的患者发生3-5级不良反应,令投资者大失所望。今天FPRX股票下滑40%。
Continue reading …


























 微信号:美中药源
微信号:美中药源