
自美国总统奥巴马在2012年7月9日签署了《FDA安全与创新法案》以来,评审“突破性药物”资格(Breakthrough Therapy Designation)作为美国FDA继快速通道、加速批准、优先审评以后的又一个特别新药评审通道正式实施。
Continue reading …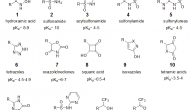
据不完全统计,全球上市的药物分子有超过450个含有羧酸官能团。带有负电荷的羧酸具有水溶性高、生物利用度好等优点,是常见的药效基团(pharmacophore)之一。
Continue reading …
【新闻事件】:福布斯上周发表文章“为何安吉丽娜•朱莉测基因要三千美元?”详细地介绍巨数遗传公司(Myriad Genetics)的BRCA专利案,再次把基因专利的双重影响推到舆论中心。
Continue reading …
5月29日,美国FDA宣布批准葛兰素史克的两个口服新药—Tafinlar(dabrafenib)胶囊和Mekinist(trametinib)片剂,用于晚期(转移性)或无法通过手术摘除的黑色素瘤这种最危险类型的皮肤癌患者。
Continue reading …
国家食品药品监督管理总局(CFDA)正在尝试将中国早期临床试验的通道放开。
记者近日从诺华中国方面确认,该公司治疗肺癌的新药“CMET激酶抑制剂”已经通过了国家食药总局的批准,首次被允许在中国境内开展药物早期临床试验(含一期临床中的一部分),该试验与美国等国家的临床进展同步,产品也有望在全球同步上市。

美中药源同意福布斯评论员Gene Marcial的看法,认为TG Therapeutics是一个值得关注的公司,尤其是其旗下新型抗CD-20单抗ublituximab颇具临床潜力。
Continue reading …
武田制药5月20日发布了旗下一款糖尿病新药Fasiglifam的积极后期临床试验数据。在熊本举行的日本糖尿病学会会议上,武田制药宣布了该药物的一项III期临床试验的数据,数据显示日服一次25mg和50mg剂量的Fasiglifam表现出明显的统计学意义,2型糖尿病患者临床相关的糖化血红蛋白水平降低。
Continue reading …
赛诺菲(Sanofi)和Regeneron制药公司21日宣布,其单抗实验药dupilumab的一个IIa期临床试验取得积极进展,用于治疗中度至重度过敏性哮喘(allergic asthma)。
Continue reading …
制药巨头辉瑞日前(5月20日)宣布终止其ADC实验药inotuzumab ozogamicin的一个关键三期临床实验。这个代号为B1931008的随机、开放标签、双组的临床实验评价inotuzumab ozogamicin对不适合高剂量化疗、复发性或难治性非霍奇金淋巴瘤(non-Hodgkin lymphoma或NHL)患者的安全性及疗效。
Continue reading …
























 微信号:美中药源
微信号:美中药源